
Las enfermedades neurodegenerativas, como la enfermedad de Alzheimer, la enfermedad de Parkinson, la Corea de Huntington, la Esclerosis Múltiple y la Esclerosis Lateral Amiotrófica, son enfermedades caracterizadas por la pérdida lenta y progresiva de una o varias funciones del sistema nervioso. Se trata de formas gravemente incapacitantes de la enfermedad, que hasta ahora sólo se han tratado con fármacos sintomáticos con poco éxito. Es una de esas cosas que, cuando te ocurre, es una sentencia definitiva. Al menos hasta ahora: en Japón, estos días, hay un rayo de esperanza…
El número de personas que sufren neurodegeneración es dramáticamente alto. El Alzheimer afecta a unos 50 millones de personas en todo el mundo[1] y esta cifra está destinada, a falta de tratamientos realmente eficaces, a aumentar drásticamente debido al incremento de la edad media y, por tanto, al aumento de la proporción de la población en riesgo. La Organización Mundial de la Salud calcula que hay 10 millones de enfermos de Parkinso[2]n y, al igual que ocurre con el Alzheimer, la incidencia aumenta significativamente a partir de los 65 años. La esclerosis múltiple afecta a más de 2,8 millones de personas[3], mientras que la ELA afecta al menos a entre 200.000 y 300.000, con un fuerte aumento anual[4].
El impacto es devastador: enfermedades como el Alzheimer son progresivas y duran una media de 10 años durante los cuales la autonomía del paciente sigue disminuyendo, lo que exige un compromiso y unos costes cada vez mayores. Además, estos pacientes apenas son hospitalizados, y más del 75% de los cuidados y la asistencia corren a cargo de sus familias, que viven un drama diario hasta ahora irresoluble. Pero la ciencia está luchando con ahínco para cambiar esta situación y, especialmente en el campo llamado enfermedad de la neurona motora, está logrando por fin el éxito. Sobre todo porque se ha empezado a trabajar en la flexibilidad de un fármaco que tenemos desde hace casi medio siglo, el Ibudilast, y que está demostrando estar lleno de agradables sorpresas.
El sistema nervioso y sus neuronas
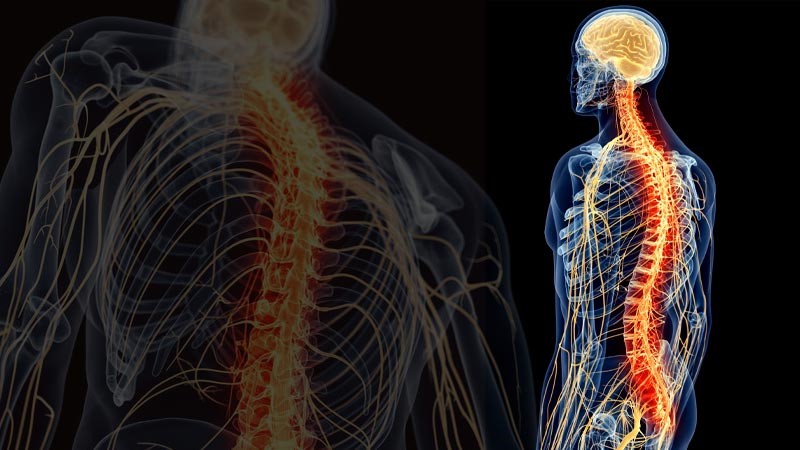
El cuerpo humano está atravesado por una compleja estructura, el sistema nervioso, que intercambia la información necesaria para activar los distintos órganos de nuestro cuerpo, muchos de los cuales funcionan, gracias al sistema nervioso, de forma involuntaria. El sistema se divide en dos subsistemas: el sistema nervioso central (SNC)[5], que afecta al cerebro, el cerebelo, la médula espinal y el tronco cerebral, y el sistema nervioso periférico (SNP)[6], que controla el resto y se divide en los sistemas autónomo y somático. Este último, el sistema voluntario o somático, rige las actividades que realizamos conscientemente, como usar un lápiz, dar una patada a una pelota, hablar, etc. El primero, el autonómico, también llamado involuntario o vegetativo, regula procesos automáticos como los latidos del corazón, la respiración, los procesos metabólicos, etc.
El primer subsistema (SNC) está formado por neuronas y fibras nerviosas que se encuentran en el cerebro, protegido por la caja craneal, y en la médula espinal, contenida en la columna vertebral. El sistema nervioso central es el laboratorio que recoge y procesa las señales del sistema periférico y desde el que se envían las órdenes al sistema periférico[7]. El sistema nervioso periférico (SNP), por su parte, está formado por los receptores y nervios que envían información desde la periferia hasta la médula espinal y el cerebro. A diferencia del sistema nervioso central, que está protegido por la caja craneal y el canal espinal, el SNP no tiene ninguna protección[8].
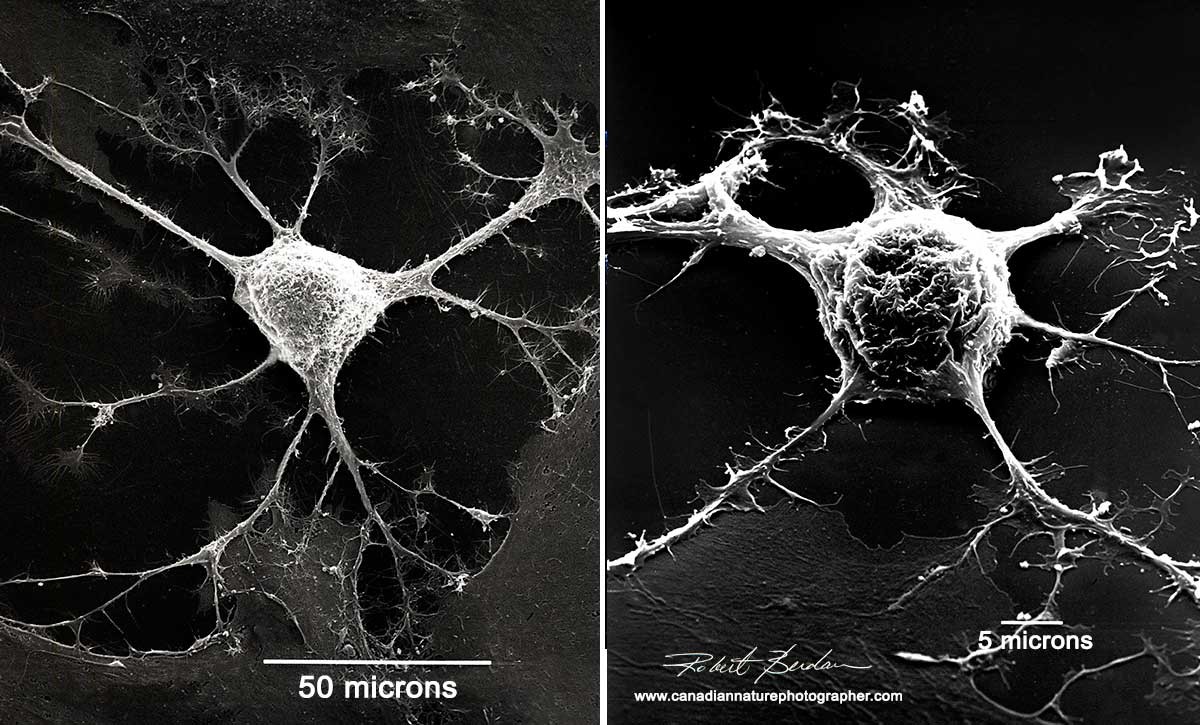
Una célula nerviosa vista al microscopio electrónico[9]
Nuestro cuerpo necesita una densa red de comunicación para permitir la transferencia de información específica de la tarea, ya sea voluntaria o involuntaria. Esta red (el sistema nervioso) está formada por tejidos (células nerviosas) que se asocian, conectan, transmiten y reciben gracias a unas partículas llamadas neuronas: son células muy especializadas que pueden intercambiar mensajes gracias a dos características que les son propias, la excitabilidad y la conductividad[10].
La excitabilidad significa que la célula nerviosa reacciona a los estímulos externos (físicos y químicos) que se convierten en impulsos nerviosos. Por ejemplo, una neurona del oído interno es excitada por una onda sonora, una neurona de la piel es excitada por el calor o el frío, una neurona del ojo por la luz, una neurona de la nariz por el olor o una neurona de un músculo por la percepción de un esfuerzo o una resistencia[11]. La conductividad significa que el impulso nervioso, generado por una célula nerviosa debido a su excitabilidad, puede transmitirse a otras células en forma de impulso eléctrico en las uniones celulares, llamadas sinapsis[12].
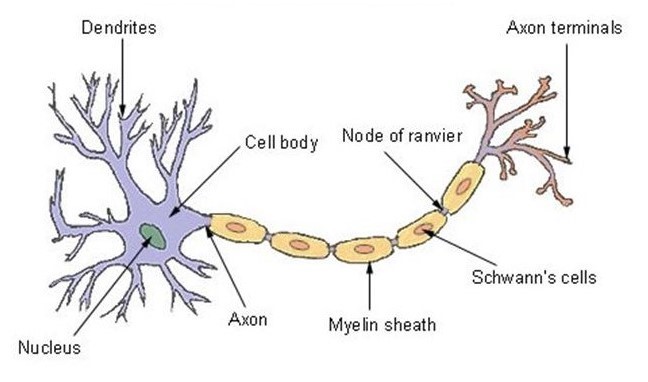
Morfología de una neurona
La neurona tiene una de las estructuras más conocidas de la naturaleza, por lo que su diseño fue copiado por el escritor Arthur C. Clarke y el director Stanley Kubrick para crear la nave espacial Discovery One de la película «2001 Una Odisea del Espacio»[13]. El núcleo, situado en la parte delantera, se llama soma y contiene las enzimas que hacen que la neurona esté activa[14]. Las partes centrales, llamadas dendritas y de forma tubular, son las ramas que -como las antenas- reciben y decodifican las señales del sistema nervioso[15].
La tercera región, el axón, es un apéndice que puede tener más de un metro de longitud -como en el caso de las neuronas que controlan los músculos voluntarios- o sólo unas micras[16]. Encargado de transmitir las señales del centro a la periferia, el axón suele tener ramas colaterales que le permiten distribuir la información a diferentes destinos al mismo tiempo[17].

La nave espacial Discovery One de la película «2001 Una Odisea del Espacio»[18]
Por lo tanto, el axón utiliza estas ramas, que se conectan en sinapsis, para permitir que las señales neuronales viajen. Estas sinapsis son conexiones entre la neurona y otras células responsables de transferir el mensaje nervioso (impulso). El mensaje está contenido en una sustancia química liberada por los axones que, antes de ser enviada, se almacena en vesículas[19].
La fibra nerviosa se compone, por tanto, del axón -que es la estructura fundamental que permite la conducción del impulso- y de una vaina que lo recubre y ayuda a aislar y proteger las fibras nerviosas, además de aumentar la velocidad de transmisión del impulso. Esta vaina se llama mielina, y no se encuentra en todas partes: en el cerebro y la médula espinal, las neuronas prescinden de esta protección[20]. La mielina es una sustancia aislante de estructura laminar, formada por moléculas de grasa y proteínas, que recubre externamente los axones de las neurona[21]s y cuya estructura inspiró la invención de la pila eléctrica hace casi 200 años[22].

La mielina tiene varias funciones: a) permite la correcta transmisión de los impulsos nerviosos, amplificando (si es necesario) su velocidad; b) protege y nutre el axón que envuelve[23]. La mielinización defectuosa de un nervio es la causa principal de varias enfermedades neurológicas: puede haber una lesión o incluso una pérdida de la vaina de mielina que rodea los nervios, ya sea por una infección o por razones metabólicas o genéticas: sea cual sea la causa, la pérdida de mielina provoca una disfunción nerviosa y la ralentización o incluso el bloqueo de la transmisión de mensajes entre las neuronas afectadas y, por tanto, de las órdenes del cerebro a las distintas partes del cuerpo[24].
Una de las enfermedades más graves y conocidas causadas por la desmielinización es la esclerosis múltiple, en la que se producen lesiones desmielinizantes del sistema nervioso central en el cerebro, que provocan diversos síntomas, como dolor, disfunción cognitiva y motora y, finalmente, trastornos visuales[25].
Neuronas motoras y esclerosis lateral amiotrófica
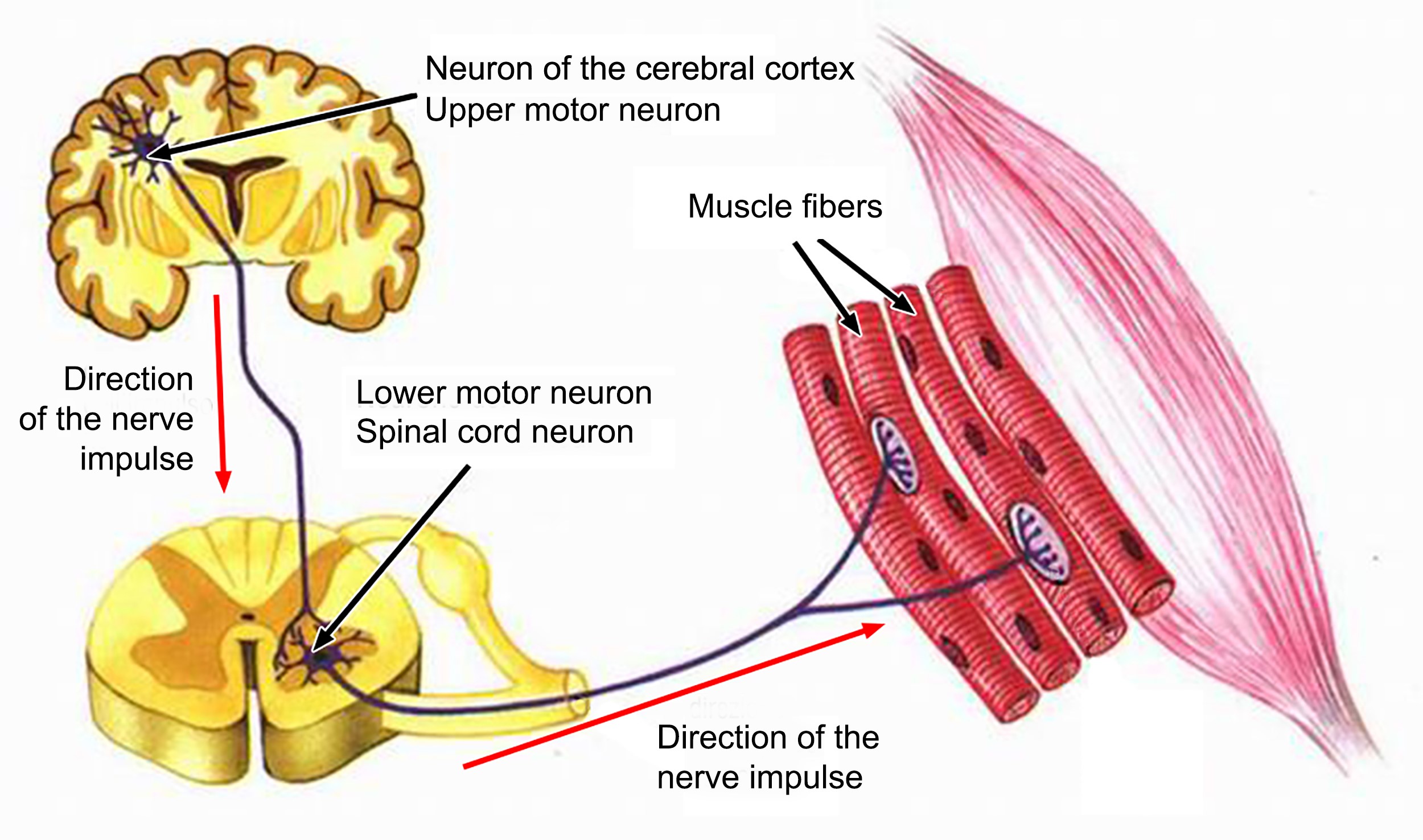
Como una nave espacial, el cuerpo es una máquina extremadamente compleja, guiada por un tipo particular, llamado neuronas motoras, porque controlan los millones de movimientos de absoluta precisión que nos permiten controlar nuestras acciones incluso en las más complejas que necesitan la coordinación de tantas funciones. Por eso existen las neuronas sensoriales o aferentes, que llevan la información de los órganos sensoriales al sistema nervioso central; y las neuronas intercalares, que toman los datos proporcionados por las neuronas sensoriales y los transmiten a las neuronas motoras. Estas últimas, las motoneuronas (o neuronas motoras), están especializadas en enviar impulsos motores y coordinados a todos los órganos de la periferia del cuerpo[26], una tarea absolutamente milagrosa.
La neurona motora es una de las células más grandes del sistema nervioso y existen dos tipos: La primera motoneurona -también llamada motoneurona central- es la célula situada en la corteza motora frontal que envía una prolongación muy larga hacia el vértice de la médula espinal para llegar, precisamente, a la segunda motoneurona. La segunda motoneurona -también conocida como motoneurona periférica- es la célula que sale del interior de la médula espinal, llega a la periferia e inerva el músculo esquelético[27]. Una estructura que, a finales de los años 70, fue utilizada por Carlo Rambaldi para crear el monstruo de la trilogía cinematográfica «Alien»[28].

La Esclerosis Lateral Amiotrófica (ELA), también conocida como enfermedad de Lou Gehrig, llamada así por el campeón de béisbol al que se le diagnosticó por primera vez[29], es una enfermedad neurodegenerativa progresiva de la edad adulta, y pertenece a un grupo de patologías que tienen en común la degeneración progresiva de un tipo específico de neuronas motoras[30]. Si la degeneración afecta a la primera motoneurona, tenemos una esclerosis lateral primaria[31]; si la infección afecta a la motoneurona periférica, tenemos una atrofia muscular progresiva[32], la que afectó al famoso astrofísico Stephen Hawking[33].
La esclerosis lateral amiotrófica (ELA), en cambio, es una enfermedad en la que ambos tipos de neuronas motoras degeneran al mismo tiempo, hasta que el paciente muere[34]. Las fibras nerviosas dejan de enviar mensajes a los músculos y, con el paso del tiempo, éstos se debilitan y sufren contracciones, llamadas fasciculaciones[35], y luego un deterioro, o atrofia[36]. Finalmente, el sistema neuronal pierde por completo la capacidad de iniciar o controlar los movimientos voluntarios.
Las causas de la ELA son, desgraciadamente, muy desconocidas, pero lo que sí es seguro es que se debe a una serie de factores que contribuyen a ella. Cada vez se está más convencido de que una mutación genética está en su origen, pero otro factor decisivo parece ser el ambiental o tóxico-ambiental: numerosas investigaciones sugieren que la contaminación causada por ciertos metales o pesticidas puede provocar el desarrollo de la enfermedad[37].
Los científicos están trabajando en la fenomenología, como la acumulación de proteínas anormales dentro de la célula o la incapacidad de la célula para eliminar estas proteínas enfermas por sí misma[38]. O el estado inflamatorio de las células gliales, que son células que contribuyen a la nutrición de las neuronas[39]. A veces hay un defecto en el mecanismo de transporte intraneuronal de señales[40] o un exceso de glutamato[41].
Quizá haya deficiencias en los factores de crecimiento de los nervios[42] o las sinapsis, o incluso en las mitocondrias, que son las células del ADN que llevan el mensaje genético que determina si somos animales o plantas, reptiles o mamíferos, hombres o mujeres[43]. Todo esto lleva a los científicos a la desesperación: seguimos intentando entender qué ocurre y cómo, pero aún no tenemos ni idea de por qué, y sin embargo hay que hacer algo, por lo que buscan alguna sustancia que, sin curar la degeneración, la ralentice o pueda detenerla.
Las etapas del control de drogas
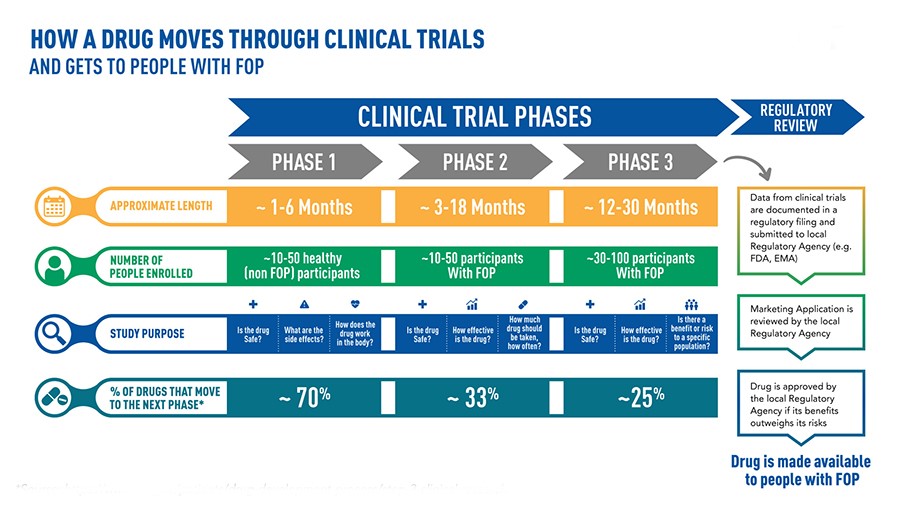
Pueden ser necesarios más de 10 años de cuidadosa planificación e investigación e incluso más de mil millones de dólares para que un medicamento pase del descubrimiento de la molécula a su comercialización[44]
En el momento en que una empresa farmacéutica cree haber descubierto un fármaco, inicia un proceso de experimentación, justamente largo y necesario para establecer la seguridad y eficacia del nuevo tratamiento[45]. Primero, en el laboratorio, se desarrolla una fase conocida como «preclínica», durante la cual se observa el nivel de toxicidad de la molécula, se evalúa la vía de administración más eficaz, así como su absorción y posterior eliminación por el cuerpo humano. Se trata de estudios en tubos de ensayo, realizados dejando que la molécula interactúe con cultivos celulares o microorganismos. Si los resultados muestran una eficacia real, entonces se prueba en animales. Si esta fase confirma la eficacia y muestra la tolerabilidad, entonces comienzan las pruebas propiamente dichas[46].
Fase 1 – Se inicia la administración en un número limitado de voluntarios sanos, cuyo objetivo principal es comprobar los efectos secundarios, ver cómo actúa el fármaco en el cuerpo humano y cómo lo maneja el organismo[47]. En los casos en los que se observan reacciones graves, o se comprueba que la eficacia está relacionada con el uso de una dosis demasiado grande, se abandona el nuevo medicamento. La carrera termina ahí.
Fase 2: se investiga el verdadero potencial terapéutico del fármaco. Esta vez, el fármaco se administra a voluntarios que padecen la enfermedad para la que se diseñó la molécula. Esta fase dura un par de años, durante los cuales se analizan los efectos positivos y negativos del uso terapéutico del principio activo -y su no toxicidad incluso en situaciones de enfermedad-[48]. Incluso en esta fase, un gran número de fármacos no pasa la prueba y se abandona.
Fase 3: se pone en marcha la posible nueva terapia. El fármaco se utiliza junto con otros ya desarrollados para las mismas enfermedades, investigando estadísticamente la relación entre riesgo y beneficio. El número de pacientes implicados aumenta y puede llegar a ser de varios miles. Durante esta fase, que puede durar hasta cinco años, se controla la aparición, la frecuencia y la gravedad de los efectos secundarios indeseables. Sólo si el medicamento demuestra ser eficaz y altamente tolerable, las agencias (como la FDA en Estados Unidos o la EMA en la Unión Europea) aprueban su distribución y comercialización[49]. Pero las pruebas aún no han terminado.
Fase 4: esta fase se denomina «vigilancia postcomercialización» porque se lleva a cabo después de que el producto se haya comercializado. Puede durar algunos años y es útil para comprobar con mayor precisión cualquier efecto indeseable poco frecuente que no se haya producido en las fases anteriores del ensayo[50]. Por lo tanto, es bastante común que durante la fase 4 las autoridades reguladoras, ante eventos graves, decidan retirar el medicamento del mercado y prohibir su administración.
MediciNova y MN-166 (Ibudilast)
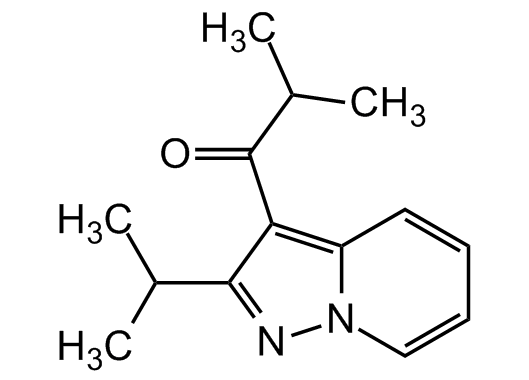
La fórmula del Ibudilast[51]
La gran esperanza de la que hablamos se llama Ibudilast (código de desarrollo MN-166), y es un medicamento propuesto por la empresa japonesa MediciNova para el tratamiento de la esclerosis lateral amiotrófica (ELA) y la esclerosis múltiple progresiva. Es una pequeña molécula que inhibe la acción de ciertas enzimas llamadas fosfodiesterasas (PDE) y es un factor inhibidor de la migración de los macrófagos (FIM)[52]: en términos sencillos, Ibudilast impide la transmisión, de la célula enferma a la célula sana, de los factores degenerativos responsables de la muerte del paciente. Los elementos químicos se unen entre sí según ciertas reglas que utilizan el fósforo para viajar de una célula a otra. Si se impide que el fósforo actúe (esta es la esperanza de los científicos), la enfermedad deja de propagarse[53].
Lo sabemos desde hace mucho tiempo. El descubrimiento del producto como inhibidor de la fosfodiesterasa se remonta a 1972, por dos médicos estadounidenses, Petko Uzunov y Benjamin Weiss[54]. En 1989, la patente de Ibudilast fue comprada por la Kyorin Pharmaceutical Company Ltd[55]. y ya entonces estaba autorizado para el tratamiento del asma[56]. Como los efectos secundarios del fármaco incluyen la relajación de los vasos sanguíneos y la dilatación de los bronquios, después del asma, el medicamento se usó contra el vértigo posterior al accidente cerebrovascular[57]. La idea de investigar el uso de Ibudilast contra la esclerosis múltiple se les ocurrió en octubre de 2004 a los médicos japoneses de un pequeño laboratorio, llamado MediciNova Inc, al que Kyorin vendió una licencia exclusiva para desarrollar y comercializar la molécula en todo el mundo (excluyendo Japón, China, Corea del Sur y Taiwán)[58].
MediciNova, un equipo de científicos japoneses que trabajan desde La Jolla (California) y Tokio[59], se fundó en septiembre de 2000 como una escisión del grupo farmacéutico Tanabe Seiyaku Company Ltd. Osaka (ahora Mitsubishi Tanabe Pharma Corporation[60]) y ahora cotiza en las bolsas de Estados Unidos y Japón. El iniciador del proyecto es el Dr. Yuichi Iwaki[61], especializado en analizar las posibilidades de los fármacos que, en su opinión, tienen un potencial de desarrollo hasta ahora subestimado por los gigantes farmacéuticos, y en aliarse después con los pequeños equipos altamente especializados que han florecido en Japón este siglo para construir nichos de mercado en el gigantesco océano del mercado estadounidense[62].
En la jerga técnica, MediciNova (MN) se especializa en el reprofiling de medicamentos, es decir, en la readaptación de un medicamento existente a un nuevo plan terapéutico mediante nuevos estudios[63]. MN trabaja en varios proyectos: MN-001 (Tipelukast), contra la esteatohepatitis no alcohólica y la fibrosis pulmonar[64]; MN-221 (Bedoradrina)[65], MN-029 (Denibulina)[66], pero sobre todo MN-166 (Ibudilast) contra trastornos neurológicos como la esclerosis múltiple (EM) progresiva, la esclerosis lateral amiotrófica (ELA), la mielopatía degenerativa cervical (MCD), la drogadicción (incluido el alcoholismo), y recientemente se está estudiando su uso en el tratamiento de los síntomas de Covid-19[67].
La intuición pareció inmediatamente acertada. Ya a finales de 1990, las investigaciones con animales revelaron la capacidad del ibudilast para contrarrestar la acumulación de calcio en el sistema nervioso central y en la aorta abdominal: evita la fosfodiesterasa, por lo que las células sanas no enferman[68]. En 1991 demostró su eficacia en los dolores de cabeza, ya que también es un vaso-relax[69]. En 1993, se confirmó su efecto beneficioso en casos de ictus isquémico[70]. Dos años después, se observó la eficacia del ibudilast en el tratamiento de los problemas de circulación sanguínea en las extremidades inferiores de los pacientes diabéticos[71].
Modelo de negocio desde 2010 de MediciNova Inc.[72]
El verdadero avance se produjo en 1996, cuando un estudio reveló que el fármaco podía contrarrestar la neurotoxicidad del glutamato en neuronas cultivadas del hipocampo de rata[73]. El glutamato, considerado uno de los neurotransmisores más importantes de nuestro sistema nervioso, ha sido durante mucho tiempo objeto de atención en relación con enfermedades neurológicas como la ELA. En algunos casos, el organismo reacciona de forma exagerada a esta enzima, lo que provoca neurotoxicidad y la consiguiente muerte neuronal. El ibudilast impide la fosfodiesterasa y, por tanto, contrarresta esta dinámica[74].
En 1997, una investigación confirmó su acción antiinflamatoria, ya que atenúa la infección de las células gliales[75]. Este descubrimiento llevó a los investigadores a probar su utilidad terapéutica en otras enfermedades respiratorias y, finalmente, en enfermedades neurológicas como la ELA o los efectos de la drogadicción[76]. En 1999, el fármaco funcionó en una enfermedad de ratas, la encefalomielitis autoinmune experimental, lo que lo convirtió en un candidato para el tratamiento clínico de pacientes con ELA[77].
En 2004 se llevó a cabo la fase preclínica y los resultados fueron más que alentadores[78]. Pero Kyorin quiere comercializarlo cuanto antes, y en 2007 se centró con éxito en el tratamiento del dolor neuropático: la farmacoterapia se basa generalmente en el uso de analgésicos opiáceos, que tienen una eficacia modesta y numerosos efectos secundarios, como la adicción y los síndromes de abstinencia. El ibudilast, utilizado en combinación con los opioides, parece tener una doble acción: la de amplificar el efecto analgésico y la de inhibir significativamente el síndrome de dependencia[79].
Aquí es donde entra MediciNova, aunque con resultados poco satisfactorios: un estudio realizado en 2010 en 297 pacientes con esclerosis múltiple terminó con una derrota al cabo de 12 meses: «El ibudilast no mostró ningún efecto beneficioso sobre la tasa de nuevas lesiones activas y recaídas. Sin embargo, las pruebas preliminares sugieren que el ibudilast parece actuar de forma neuroprotectora (…) con un posible efecto clínico beneficioso sobre la progresión de la discapacidad»[80].
MediciNova no da por perdida la partida y experimenta con el MN-166 (nombre del Ibudilast en el catálogo del laboratorio de Yuichi Iwaki) en combinación con otros tratamientos: el objetivo no es curar la ELA, sino sólo ralentizar la progresión de sus síntomas. Sobre esta base, en 2012 la FDA (Food and Drug Administration) aprobó el inicio del ensayo clínico de fase 2 (IBU-ALS-1201), cuyo objetivo principal es evaluar la seguridad y tolerabilidad de MN-166 en el tratamiento de la esclerosis lateral amiotrófica en sujetos humanos[81].
Ese mismo año se firmó un acuerdo de desarrollo conjunto entre MediciNova y la Universidad de Colorado para el tratamiento de las lesiones cerebrales postraumáticas[82]. En 2013, MediciNova inició un estudio de fase 2b (NCT01982942), destinado a verificar la seguridad, la tolerabilidad y la actividad de ibudilast en sujetos con esclerosis múltiple progresiva[83]. El estudio se lleva a cabo en colaboración con los Institutos Nacionales de la Salud (NIH)[84], el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (NINDS)[85] y la Sociedad Nacional de Esclerosis Múltiple[86]. La América farmacéutica empezó a creer en el proyecto.
Después, los resultados positivos llegaron con la lentitud propia de un proceso relacionado con una enfermedad tan terrible. En 2015, una investigación afirma que los ratones convertidos en dependientes del alcohol, al ser tratados con ibudilast, reducen su dependencia en un 50%[87]. Un equipo de otra empresa, tras un minucioso análisis preclínico, afirma que, aunque no se ha encontrado una disminución de la inflamación en la esclerosis múltiple, está claro que Ibudilast tiene un efecto positivo en la conservación del volumen cerebral y, por tanto, frena la progresión de la discapacidad[88]. En octubre de 2016, la FDA concedió otros siete años de exclusividad a MediciNova para continuar los estudios y ensayos de este proyecto[89].

Un miembro del personal de los Laboratorios MediciNova trabajando
En marzo de 2018 Iwaki decidió abandonar los ensayos de tratamiento farmacológico: los resultados eran demasiado pobres[90]. La FDA lo anima, afirmando que los resultados dicen que el MN-166 «reduce el craving (y, por tanto, la adicción) y mejora el funcionamiento cognitivo»[91] ofreciendo a MediciNova continuar con la fase 2. En agosto de 2018, MediciNova anunció el lanzamiento de un estudio de fase 2 de MN-166 en mielopatía cervical degenerativa en colaboración con la Universidad de Cambridge y Cambridge University Hospitals NHS Foundation Trust[92]. El estudio se centra en la capacidad de la molécula para promover el crecimiento de los nervios en las lesiones traumáticas de la médula espinal. El estudio concluye con un triunfo el 19 de marzo de 2020[93]. Los resultados del estudio de fase 2 son, en efecto, muy alentadores[94]: el tratamiento con MN-166 tiene un efecto de ralentización de la progresión de la enfermedad y, además, ejerce un efecto protector, reduciendo significativamente el riesgo de nuevas lesiones inflamatorias[95].
Estos resultados convencieron a la FDA de que el fármaco tiene realmente futuro, y se concedió la aprobación para la fase 3[96], a pesar de que el pequeño laboratorio no dispone de la infraestructura exigida por la ley para verificar los resultados de cada administración, de cada terapia y de cada paciente, lo que se conoce en la industria farmacéutica como «punto final» que determina la idoneidad de un tratamiento[97]. Pero Estados Unidos considera que la esclerosis es tan grave que en 2015 decidió ampliar la red de productos especialmente prometedores para las enfermedades «huérfanas», porque aún son incurables[98]. Para obtener el estatus de fase 3, MediciNova debe demostrar que cuenta con un gran número de pacientes dispuestos a asumir el riesgo, y con la esclerosis no es difícil encontrarlos[99]. Así que el ensayo clínico de fase 3 comienza en el verano de 2020[100].
En agosto, la Asociación Americana de Psicología, que llevó a cabo un examen cruzado del MN-166, confirmó que el Ibudilast reduce significativamente los antojos diarios en los alcohólicos[101]. Unos meses más tarde, en diciembre, la FDA aprobó el uso de MN-166 en combinación con otro fármaco, el interferón beta, para el tratamiento de la esclerosis múltiple progresiva[102]. En enero de 2021, las autoridades japonesas concedieron a MediciNova una licencia para utilizar el MN-166 en combinación con el riluzol (un fármaco que impide la acción negativa del glutamato[103]) para el tratamiento de la esclerosis lateral amiotrófica (ELA)[104].
Hace unos días, MediciNova firmó un contrato con BARDA (Biomedical Advanced Research and Development Authority[105]) para ensayar el MN-166 como contramedida contra los daños pulmonares inducidos por el gas cloro, como el síndrome de dificultad respiratoria aguda (SDRA) y la lesión pulmonar aguda (LPA)[106]. Parece que estamos a un paso de poder decir a los miles de nuevos pacientes de esclerosis que hay una esperanza real. Pero la carrera sigue siendo larga, cuesta arriba y llena de dificultades.
Esa interminable carrera de obstáculos

Fase II: Los investigadores descubrieron que el daño cerebral en un grupo de pacientes se redujo en una media de 2,5 mililitros más que con otros tratamientos, una diferencia de alrededor del 48%[107]
La investigación y el desarrollo de medicamentos tienen unos costes impresionantes. Según un estudio publicado en la revista Jama Network en marzo de 2020[108], el desarrollo de un nuevo medicamento cuesta una media de 985 millones de dólares, y oscila entre un mínimo de 314 millones y un máximo de 2.800 millones[109]. Una empresa farmacéutica puede tardar hasta 15 años en ver su producto a la venta y, si lo deja a medias porque se ha acabado el dinero, no queda nada.
La competencia es un riesgo importante. A menudo hay varias empresas trabajando en el mismo medicamento al mismo tiempo, y sólo una gana. Así, se corre el riesgo de haber invertido millones de dólares durante años en un tratamiento y verse superado en la última milla por un medicamento más eficaz desarrollado por un competidor, mejor tolerado y también posiblemente más barato. La carrera es aún más dura para las pequeñas empresas que acaban de empezar y aún no tienen un medicamento de éxito en el mercado: MediciNova registró una pérdida neta de 13,9 millones de dólares sólo en 2020. Si se calculan los costes desde que se inició el juicio del MN-166, ya estamos en 382,9 millones de dólares. Hasta que el MN-166 o uno de los otros nuevos medicamentos entre en producción, las cosas empeorarán[110].
La verdad es que MediciNova se está ahogando en deudas. Ha reducido el número de empleados de 25 (2009) a 8 (2019)[111], y la única esperanza es entrar en alianzas estratégicas con grandes empresas farmacéuticas que crean en el futuro de MN-166 y MN-001[112], pero en este punto el equipo del Dr. Iwaki se ha equivocado mucho. En nuestra investigación, nos pusimos en contacto con tres empresas multinacionales, y la respuesta fue siempre la misma: ¿por qué íbamos a hacer un trato y pagar 100 por lo que presumiblemente pagaríamos 10 tras el fracaso de MediciNova? La empresa, ávida de capital, decidió centrar su estrategia en el desarrollo de una vacuna contra el Covid-19 y, en julio de 2020, anunció el inicio del desarrollo de un nuevo fármaco junto con BioComo Inc. Tsu[113] y el socio institucional de Biocomo, la Universidad de Mie en Tsu[114].
Pero este medicamento no funciona. En marzo de 2021, MediciNova cancela el proyecto[115] y lo sustituye por una asociación, iniciada con BARDA (Biomedical Advanced Research and Development Authority), que se compromete a apoyar financiera y tecnológicamente el desarrollo del MN-166[116]. El anuncio hizo que el precio de las acciones de MediciNova Inc. se disparara hasta duplicarse[117]. Ese dinero recaudado en la bolsa es como el maná del cielo. Mientras tanto, MediciNova tiene en el mercado el MN-221 para el asma y una versión del MN-166 combinada con riluzol para el tratamiento de la esclerosis lateral amiotrófica (ELA), a la que debería concederse una licencia permanente en un futuro próximo[118].
Es una carrera contrarreloj, ya que la patente expirará en noviembre de 2035[119], y como el Ibudilast es una patente de 1989, a partir de 2039 se convertirá en una patente libre de todos modos, como la aspirina, y cualquiera podrá venderla, sin importar el dinero que MediciNova haya invertido en su desarrollo. Mientras tanto, en Estados Unidos, el MN-166 se está administrando en muchas clínicas universitarias a los pacientes que se inscriben para hacerse cargo de él. La esclerosis múltiple es una enfermedad que destruye al ser humano al que afecta, y lo hace de forma lenta, feroz e incontrolable. Cuando la gente cree que la industria farmacéutica es el País de los Juguetes, donde todos consiguen ganar sumas exorbitantes de dinero sin que los costes justifiquen los precios de lista, deberían recordar esta historia. Y reza, porque si el Ibudilast realmente funciona, como parece, cada día perdido es una vida humana perdida.
[1] https://www.who.int/news-room/fact-sheets/detail/dementia#:~:text=Worldwide%2C%20around%2050%20million%20people,60%E2%80%9370%25%20of%20cases.
[2] https://comitatoparkinson.it/i-numeri-del-parkinson-in-italia/#:~:text=%E2%80%9CMEDICINA%3A%20Parkinson%2C%20400%20mila,%C3%A8%20legata%20all’et%C3%A0%20avanzata.
[3] https://journals.sagepub.com/doi/full/10.1177/1352458520970841#:~:text=A%20total%20of%202.8%20million,gaps%20in%20prevalence%20estimates%20persist.
[4] https://www.karger.com/Article/Fulltext/493386
[5] https://www.sciencedirect.com/science/article/pii/B9780123750006000847
[6] https://www.sciencedirect.com/science/article/pii/B9780750614474500074
[7] https://www.sciencedirect.com/science/article/pii/B9780123750006000847
[8] https://www.sciencedirect.com/science/article/pii/B9780750614474500074
[9] https://microspedia.blogspot.com/2020/11/real-electron-microscope-nerve-cell.html
[10] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[11] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[12] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[13] Gilles Clément, Angie Buckey, William Paloski, “Artificial Gravity – History of artificial gravity”, Springer Science & Business, Berlin 2007, pages 62-65; https://www.ncbi.nlm.nih.gov/books/NBK21535/
[14] https://www.newworldencyclopedia.org/entry/Soma_(biology)
[15] https://www.newworldencyclopedia.org/entry/Dendrite
[16] https://itechmedicaldivision.com/elettrostimolazione-e-contrazione-volontaria/
[17] https://www.newworldencyclopedia.org/entry/Axon
[18] https://www.syfy.com/syfywire/go-beyond-the-infinite-with-2001-a-space-odysseys-discovery
[19] https://www.newworldencyclopedia.org/entry/Axon
[20] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[21] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[22] https://web.archive.org/web/20111107033302/http://www.storiain.net/arret/num50/artic6.htm ; www.monci.it/homogubernator/Elettromagnetismo/2E_Pile_Zamboni.htm
[23] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[24] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1860500/
[25] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1860500/
[26] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4191298/
[27] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4191298/
[28] https://alienanthology.fandom.com/wiki/The_Beast_Within:_The_Making_of_Alien
[29] https://www.rchsd.org/health-articles/lou-gehrigs-disease-als/
[30] https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-Sheets/Motor-Neuron-Diseases-Fact-Sheet
[31] https://www.policlinicocampusbiomedico.it/malattie/sclerosi-laterale-primaria#:~:text=La%20sclerosi%20laterale%20primaria%20%C3%A8,andamento%20dei%20sintomi%20%C3%A8%20progressivo.
[32] https://pubmed.ncbi.nlm.nih.gov/26515620/
[33] https://studiodiagnosticopantheon.it/latrofia-muscolare-progressiva-la-malattia-di-stephen-hawking/
[34] https://www.ninds.nih.gov/disorders/patient-caregiver-education/fact-sheets/amyotrophic-lateral-sclerosis-als-fact-sheet
[35] https://www.rxlist.com/fasciculation/definition.htm
[36] https://medlineplus.gov/ency/article/003188.htm
[37] https://www.aisla.it/vivere-con-la-sla/ipotesi-sulle-cause-della-sla/
[38] https://link.springer.com/article/10.1007/s00401-009-0545-9
[39] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4241182/
[40] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5536153/
[41] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2842587/
[42] https://pubmed.ncbi.nlm.nih.gov/21706151/
[43] https://pubmed.ncbi.nlm.nih.gov/17204932/
[44] https://toolbox.eupati.eu/resources/realizzare-un-farmaco-fase-6-fase-i-prova-del-meccanismo/?lang=it
[45] https://www.aifa.gov.it/sperimentazione-clinica-dei-farmaci
[46] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[47] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[48] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[49] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[50] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[51] http://www.arisla.org/?p=8686
[52] https://www.openaccessjournals.com/articles/ibudilast-for-the-treatment-of-drug-addiction-and-other-neurological-conditions.pdf
[53] https://www.openaccessjournals.com/articles/ibudilast-for-the-treatment-of-drug-addiction-and-other-neurological-conditions.pdf
[54] https://chemport.cas.org/cgi-bin/sdcgi?APP=ftslink&action=reflink&origin=npg&version=1.0&coi=1%3ACAS%3A528%3ADyaE38XlsVyqtLw%3D&md5=93f10eb1f2cc78a01c54153040f0fdf4 ; https://www.sciencedirect.com/science/article/abs/pii/0005274472900605?via%3Dihub
[55] https://www.kyorin-pharm.co.jp/en/
[56] https://pubmed.ncbi.nlm.nih.gov/2556092/
[57] https://pubchem.ncbi.nlm.nih.gov/compound/3671
[58] https://materials.proxyvote.com/default.aspx?docHostID=322881
[60] https://www.mt-pharma.co.jp/e/
[61] https://www.crunchbase.com/person/yuichi-iwaki
[62] https://plus.credit-suisse.com/rpc4/ravDocView?docid=V6A35B2AK-e
[63] https://www.nature.com/articles/nrd.2018.168 ; https://plus.credit-suisse.com/rpc4/ravDocView?docid=V6A35B2AK-e
[64] https://medicinova.com/clinical-development/core/mn-001-nash/
[65] https://medicinova.com/clinical-development/core/mn-221/
[66] https://medicinova.com/clinical-development/non-core/mn-029/medicinova-approach/ ; https://www.sec.gov/Archives/edgar/data/1226616/000156459019002835/mnov-10k_20181231.htm
[67] https://medicinova.com/clinical-development/core/mn-166/ ; https://www.scienceboard.net/index.aspx?sec=sup&sub=Drug&pag=dis&ItemID=1749
[68] https://pubmed.ncbi.nlm.nih.gov/2257963/
[69] https://headachejournal.onlinelibrary.wiley.com/doi/abs/10.1111/j.1526-4610.1991.hed3107483_1.x?sid=nlm%3Apubmed
[70] https://www.tandfonline.com/doi/abs/10.1080/01616412.1993.11740130
[71] https://journals.sagepub.com/doi/10.1177/000331979504600808
[72] Slide Presentation (sec.gov)
[73] https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1440-1681.1996.tb02772.x
[74] https://lamenteemeravigliosa.it/il-glutammato-neurotrasmettitore-multifunzione/
[75] https://pubmed.ncbi.nlm.nih.gov/9396033/
[76] http://rsds.org/wp-content/uploads/2015/02/Rolan_Ibudilast_Review.pdf
[77] https://www.jni-journal.com/article/S0165-5728(98)00251-3/fulltext
[78] https://journals.sagepub.com/doi/10.1191/1352458504ms1070oa ; https://www.sciencedirect.com/science/article/abs/pii/S0028390803003721?via%3Dihub
[79] https://www.tandfonline.com/doi/abs/10.1517/13543784.16.7.935?journalCode=ieid20 ; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2662518/
[80] https://n.neurology.org/content/74/13/1033
[81] https://clinicaltrials.gov/ct2/show/record/NCT02238626
[82] https://connections.cu.edu/stories/cu-boulder-medicinova-collaborate-brain-injury-therapy
[83] https://clinicaltrials.gov/ct2/show/study/NCT01982942
[84] https://www.ninds.nih.gov/
[85] https://www.ninds.nih.gov/
[86] https://www.nationalmssociety.org/
[87] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4017009/
[88] https://www.tandfonline.com/doi/abs/10.1080/13543784.2016.1221924?journalCode=ieid20
[89] https://alsnewstoday.com/news-posts/2016/10/18/ibudilast-mn-166-named-orphan-drug-for-amyotrophic-lateral-sclerosis-by-fda/
[90] https://www.globenewswire.com/news-release/2018/03/29/1455342/0/en/MediciNova-Announces-Results-of-Phase-2-Clinical-Trial-of-MN-166-ibudilast-in-Methamphetamine-Dependence.html
[91] https://www.researchgate.net/publication/297599603_Ibudilast_attenuates_subjective_effects_of_methamphetamine_in_a_placebo-controlled_inpatient_study
[92] https://www.globenewswire.com/news-release/2018/08/06/1547763/0/en/MediciNova-Announces-Initiation-of-NIHR-Grant-Funded-Phase-2-3-Trial-of-MN-166-ibudilast-for-the-Treatment-of-Degenerative-Cervical-Myelopathy-in-Collaboration-with-the-University-.html
[93] https://www.clinicaltrialsregister.eu/ctr-search/trial/2017-004856-41/GB#A
[94] https://www.nejm.org/doi/full/10.1056/NEJMoa1803583?query=featured_home
[95] https://www.globenewswire.com/news-release/2008/09/18/385032/150688/en/Data-From-MediciNova-s-Two-Year-Phase-II-Clinical-Trial-of-MN-166-in-Multiple-Sclerosis-Presented-At-the-World-Congress-for-Treatment-and-Research-in-MS-WCTRIMS.html ; https://www.nejm.org/doi/full/10.1056/NEJMoa1803583?query=featured_home
[96] http://www.globenewswire.com/news-release/2018/09/25/1576125/0/en/MediciNova-Announces-Positive-FDA-Feedback-Regarding-Phase-3-Plan-for-MN-166-ibudilast-in-ALS.html
[97] https://www.sec.gov/Archives/edgar/data/1226616/000156459019002835/mnov-10k_20181231.htm
[98] https://www.fdanews.com/articles/172717-fda-indicates-flexibility-in-drug-development-for-rare-diseases?utm_source=Real%20Magnet&utm_medium=Email&utm_campaign=80249611
[99] https://www.regulations.gov/document/FDA-2015-D-2818-0002 “Rare Diseases: Common Issues in Drug Development Guidance for Industry” U.S. Department of Health and Human Services – Food and Drug Administration – Center for Drug Evaluation and Research (CDER) – Center for Biologics Evaluation and Research (CBER) – August 2015
[100] http://www.arisla.org/?p=8686
[101] https://www.biospace.com/article/releases/medicinova-announces-the-presentation-of-positive-results-from-phase-2-trial-of-mn-166-ibudilast-in-alcohol-use-disorder-at-the-american-psychological-association-2020-annual-convention/
[102] https://www.globenewswire.com/news-release/2020/12/29/2151193/0/en/MediciNova-Receives-Notice-of-Allowance-for-New-Patent-Covering-MN-166-ibudilast-for-the-Treatment-of-Progressive-MS.html
[103] https://medisoc.it/scheda-riluzolo/
[104] https://seekingalpha.com/pr/18155450-medicinova-receives-notice-of-allowance-for-new-patent-covering-combination-of-mnminus-166
[105] https://www.phe.gov/about/barda/Pages/default.aspx
[106] https://www.globenewswire.com/news-release/2021/03/09/2189908/0/en/MediciNova-Announces-Partnership-with-BARDA-to-Develop-MN-166-ibudilast-as-a-Medical-Countermeasure-Against-Chlorine-Gas-induced-Lung-Injury.html
[107] https://news.ohsu.edu/2018/09/05/study-suggests-potential-of-new-therapy-for-progressive-multiple-sclerosis
[108] Autore Olivier J. Wouters, PhD, Department of Health Policy, London School of Economics and Political Science, Houghton Street, London WC2A 2AE, United Kingdom.
[109] https://jamanetwork.com/journals/jama/article-abstract/2762311
[110] https://sec.report/Document/0001564590-21-006771/#ITEM_7_MANAGEMENTS_DISCUSSION_ANALYSIS_1 pag. 55
[111] https://www.macrotrends.net/stocks/charts/MNOV/medicinova/number-of-employees
[112] https://sec.report/Document/0001564590-21-006771/#ITEM_7_MANAGEMENTS_DISCUSSION_ANALYSIS_1 pag. 55
[113] http://biocomo.jp/english.html
[114] https://www.globenewswire.com/news-release/2020/07/27/2067757/0/en/MediciNova-Announces-SARS-CoV-2-Vaccine-Joint-Development-with-BioComo-and-Mie-University-Japan.html
[115] https://www.theglobeandmail.com/investing/markets/stocks/MNOV-Q/pressreleases/1242556/
[116] https://drive.hhs.gov/ReDIRECT.html
[117] https://www.nasdaq.com/articles/medicinova-partners-with-barda-to-develop-chlorine-gas-induced-lung-injury-treatment-stock
[118] https://seekingalpha.com/pr/18155450-medicinova-receives-notice-of-allowance-for-new-patent-covering-combination-of-mnminus-166
[119] https://alsnewstoday.com/news-posts/2019/01/23/medicinova-closer-to-us-patent-ibudilast-rilutek-combo-for-als-neurodegenerative-diseases/
Deja una respuesta