
Neurodegenerative Erkrankungen wie Alzheimer, Parkinson, Huntington, Multiple Sklerose und Amyotrophe Lateralsklerose (ALS) sind Erkrankungen, die durch den langsamen und fortschreitenden Verlust einer oder mehrerer Funktionen des Nervensystems gekennzeichnet sind. Dies sind stark behindernde Erkrankungen, die bisher durch die Verabreichung rein symptomatischer Medikamente mit schlechten Ergebnissen behandelt wurden. Es ist eines dieser Dinge, die, wenn sie dir passieren, ein endgültiges Urteil bedeuten. Zumindest bis heute: In Japan gibt es nun ein Funken Hoffnung …
Die Zahl der Menschen mit Neurodegeneration ist dramatisch hoch. Alzheimer betrifft weltweit etwa 50 Millionen Menschen[1] und diese Zahl wird durch den Mangel wirksamer Behandlungen, den Anstieg des Durchschnittsalters und somit durch den wachsenden Anteil der gefährdeten Bevölkerung drastisch zunehmen. Nach Schätzungen der Weltgesundheitsorganisation leiden 10 Millionen Menschen an Parkinson[2] und wie bei Alzheimer steigt die Inzidenz nach 65 Jahren signifikant an. Multiple Sklerose betrifft über 2,8 Millionen Menschen[3], während ALS wegen eines starken jährlichen Anstiegs mindestens zwischen 200.000 und 300.000 Patienten lähmt[4].
Die Auswirkungen sind verheerend: Krankheiten wie Alzheimer sind fortschreitend und haben eine durchschnittliche Dauer von 10 Jahren, in denen die Autonomie des Patienten immer weiter abnimmt, was Engagement der Verwandtschaft sowie steigende Kosten erfordert. Darüber hinaus werden diese Patienten fast nie ins Krankenhaus eingeliefert: Über 75 % der Pflege und Unterstützung wird von den Familien geleistet, die täglich eine bisher unlösbare Tragödie erleben. Die Wissenschaft kämpft jedoch mit aller Kraft, um diese Situation zu ändern und insbesondere auf dem Gebiet der Motoneuronen wird sie endlich erfolgreich. Wir haben angefangen, an der Flexibilität eines Arzneimittels zu arbeiten, über das wir seit fast einem halben Jahrhundert verfügen: das Ibudilast. Es stellt sich heraus, dass dieses Mittel voller erfreulicher Überraschungen steckt.
Das Nervensystem und seine Neuronen

Der menschliche Körper wird von einer komplexen Struktur durchquert, dem Nervensystem, das die Informationen austauscht, die zur Aktivierung der einzelnen Organe unseres Körpers erforderlich sind. Viele davon arbeiten dank des Nervensystems selbstständig. Das System ist in zwei Subsysteme unterteilt: das Zentralnervensystem (ZNS)[5], das das Gehirn, das Kleinhirn, das Rückenmark und den Hirnstamm betrifft, und das periphere Nervensystem (PNS)[6], das den Rest steuert und in das autonome und das somatische System unterteilt ist … Letzteres, das somatische oder freiwillige, regelt die Aktivitäten, die wir bewusst ausführen, wie z. B. die Verwendung eines Bleistifts, das Treten eines Balls, das Sprechen usw. Das Erste, das autonome, auch unwillkürliche oder vegetative genannt, reguliert automatische Prozesse wie Herzschlag, Atmung, Stoffwechselprozesse und so weiter.
Das erste Subsystem (ZNS) besteht aus Neuronen und Nervenfasern im Gehirn, die durch den Schädel geschützt sind, und im Rückenmark, das in der Wirbelsäule enthalten ist. Das Zentralnervensystem ist das Labor, das die Signale sammelt und verarbeitet, die vom peripheren System kommen und von denen die Befehle an das periphere System zurückgehen[7]. Das periphere Nervensystem (PNS) besteht dagegen aus Rezeptoren und Nerven, die Informationen von der Peripherie an die Medulla und das Gehirn senden. Im Gegensatz zum Zentralnervensystem, das durch den Schädel und den Wirbelkanal geschützt ist, hat das PNS keinen Schutz[8].

Eine Nervenzelle unter einem Elektronenmikroskop[9]
Unser Körper benötigt ein dichtes Kommunikationsnetzwerk, um die Übertragung spezifischer Informationen für jede automatische oder bewusste Aufgabe zu ermöglichen. Dieses Netzwerk (das Nervensystem) besteht aus einem Gewebe (Nervenzellen), das von Partikeln, die als Neuronen bezeichnet werden, assoziiert, verbunden, übertragen und empfangen wird. Es handelt sich um hoch spezialisierte Zellen, die dank zweier eigener Merkmale Nachrichten austauschen können: Erregbarkeit und Leitfähigkeit[10].
Erregbarkeit bedeutet, dass die Nervenzelle auf äußere (physikalische und chemische) Reize reagiert, die in einen Nervenimpuls umgewandelt werden. Zum Beispiel wird ein Neuron im Innenohr durch eine Schallwelle angeregt, das der Haut durch Hitze oder Kälte, das des Auges durch Licht, das olfaktorische durch einen Geruch oder das des Muskels durch die Wahrnehmung von einer Anstrengung oder einem Widerstand[11]. Leitfähigkeit hingegen bedeutet, dass der Nervenimpuls, der von einer Nervenzelle aufgrund ihrer Erregbarkeit erzeugt wird, in Form eines elektrischen Impulses an Zellübergängen, sogenannten Synapsen, auf andere Zellen übertragen werden kann[12].

Morphologie eines Neurons
Das Neuron hat eine der bekanntesten Strukturen in der Natur. Aus diesem Grund wurde sein Design vom Schriftsteller Arthur C. Clarke und dem Regisseur Stanley Kubrick kopiert, um das Raumschiff Discovery One für den Film „2001 A Space Odyssey“ zu erstellen[13]. Der auf der Vorderseite befindliche Kern wird Soma genannt und enthält die Enzyme, die das Neuron aktiv machen[14]. Die zentralen Teile, Dendriten genannt, sind Verzweigungen, die – wie Antennen – die vom Nervensystem kommenden Signale empfangen und decodieren[15].
Die dritte Region, das Axon, ist ein geformter Anhang, der sogar einen Meter lang sein kann – wie im Fall der Neuronen, die selbstbeherrschte Muskeln steuern – oder nur wenige Mikrometer lang sein kann[16]. Das Axon ist stellvertretend bei der Übertragung von Signalen vom Zentrum zur Peripherie und weist häufig Kollateralverzweigungen auf, die es dem Axon ermöglichen, Informationen gleichzeitig an verschiedene Ziele zu verteilen[17].

Das Raumschiff Discovery One aus dem Film „2001 A Space Odyssey“[18]
Das Axon verwendet daher diese Zweige, die sich in Synapsen verbinden, um die Übertragung neuronaler Signale zu ermöglichen. Diese Synapsen sind Verbindungen zwischen dem Neuron und anderen Zellen, die für die Übertragung der Nervenbotschaft (Impuls) verantwortlich sind. Die Nachricht ist in einer Chemikalie enthalten, die von den Axonen freigesetzt wird und vor dem Senden in Vesikeln gespeichert wird[19].
Die Nervenfaser besteht daher aus dem Axon – der Grundstruktur, die die Leitung des Impulses ermöglicht. Es wird von einer Hülle umwickelt, die dazu beiträgt, die Nervenfasern zu isolieren und zu schützen; zusätzlich dient sie dazu, die Übertragungsgeschwindigkeit erheblich zu erhöhen. Diese Hülle heißt Myelin und ist nicht überall zu finden: Im Gehirn und Rückenmark verzichten Neuronen auf diesen Schutz[20]. Myelin ist eine isolierende Substanz mit einer Lamellenstruktur, die aus Molekülen von Fetten und Proteinen besteht, die die Axone von Neuronen von außen umwickelt[21] und deren Struktur vor fast 200 Jahren die Erfindung der elektrischen Zelle inspirierte[22].
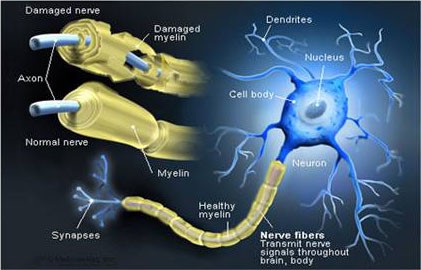
Die Funktionen des Myelins sind unterschiedlich: a) es ermöglicht die korrekte Übertragung von Nervenimpulsen und verstärkt (falls erforderlich) deren Geschwindigkeit; b) schützt und nährt das Axon, das es umhüllt[23]. Eine fehlerhafte Myelinisierung eines Nervs ist die Hauptursache für verschiedene neurologische Erkrankungen: Es kommt vor, dass die Nerven von einer Läsion oder sogar einem Verlust der Myelinscheide betroffen sind – entweder aufgrund einer Infektion oder aus metabolischen oder genetischen Gründen: Was auch immer es ist, denn der Verlust von Myelin führt zu einer Funktionsstörung der Nerven und zu einer Verlangsamung oder sogar Blockierung der Übertragung von Nachrichten zwischen den betroffenen Neuronen und damit der Gehirnbefehle an die einzelnen Körperteile[24].
Eine der schwerwiegendsten und bekanntesten Krankheiten, die durch Demyelinisierung verursacht werden, ist Multiple Sklerose, bei der demyelinisierende Läsionen des Zentralnervensystems im Gehirn auftreten und verschiedene Symptome wie Schmerzen, kognitive und motorische Dysfunktionen und letztendlich Sehstörungen verursachen[25].
Motoneuronen und Amyotrophe Lateralsklerose

Wie ein Raumschiff ist der Körper eine äußerst komplexe Maschine, die von einer bestimmten Kraft angetrieben wird, die als Motoneuronen bezeichnet wird, da sie die Millionen von Bewegungen mit absoluter Präzision steuern, die es uns ermöglichen, unsere Aktionen selbst bei den komplexesten Aktionen zu steuern, deren Koordination von vielen Funktionen erforderlich ist. Dafür gibt es sensorische oder afferente Neuronen, die Informationen von den Sinnesorganen zum Zentralnervensystem transportieren; und interkalare Neuronen, die die von sensorischen Neuronen bereitgestellten Daten aufnehmen und an Motoneuronen übertragen. Letztere, die Motoneuronen, sind darauf spezialisiert, motorische und koordinierte Impulse auf jedes einzelne Organ der Körperperipherie zu übertragen[26] – eine Aufgabe, die absolut einem Wunder gleicht.
Das Motoneuron ist eine der größten Zellen im Nervensystem und es gibt zwei Arten davon: Das erste Motoneuron – auch als zentral bezeichnet – ist die Zelle im frontalen Motorcortex, die eine sehr lange Ausdehnung nach unten bis zur Spitze des Rückenmarks (Medulla spinalis) hat, um das zweite Motoneuron zu erreichen. Das zweite Motoneuron – auch peripher genannt – ist die Zelle, die aus dem Rückenmark austritt, die Peripherie erreicht und den Skelettmuskel innerviert[27]. Eine Struktur, die Ende der 70er-Jahre von Carlo Rambaldi verwendet wurde, um das Monster der Filmtrilogie „Alien“ zu erschaffen[28].
Amyotrophe Lateralsklerose (ALS), auch bekannt als Lou Gehrig-Krankheit (benannt nach dem Namen des erstmals mit der Krankheit diagnostizierten Baseball-Champions[29]), ist eine fortschreitende neurodegenerative Erkrankung im Erwachsenenalter und gehört zu einer Gruppe von Erkrankungen, die die fortschreitende Degeneration eines bestimmten Typs von Motoneuronen beeinflussen[30]. In dem Fall, dass die Degeneration das erste Motoneuron betrifft, haben wir die primäre Lateralsklerose[31] und in dem Fall, dass die Infektion das periphere Motoneuron betrifft, haben wir eine spinale Muskelatrophie[32] – die bei dem bekannten Astrophysiker Stephen Hawking diagnostiziert wurde[33].
Amyotrophe Lateralsklerose (ALS) ist stattdessen eine Krankheit, bei der beide Arten von Motoneuronen, sowohl die erste als auch die zweite bis zum Tod des Patienten gleichzeitig progressiv degenerieren[34]. Die Nervenfasern hören auf, Nachrichten an die Muskeln zu senden und im Laufe der Zeit führt dies zu unwillkürlichen Muskelzuckungen (Faszikulationen), Muskelschwund und Muskelschwäche[35]. Schließlich verliert das neuronale System vollständig die Fähigkeit, selbstbeherrschte Bewegungen zu initiieren oder zu steuern.
Die Ursachen sind leider weitgehend unbekannt, aber was sicher ist, ist, dass ALS durch eine Reihe von Ursachen bestimmt wird. Der Glaube, dass es eine genetische Mutation an der Basis gibt, nimmt immer mehr zu, aber ein weiterer entscheidender Faktor scheint der umweltbedingte oder toxisch-umweltbedingte zu sein: Zahlreiche Untersuchungen lassen vermuten, dass die durch einige Metalle oder Pestizide verursachte Verschmutzung die Entwicklung der Krankheit verursachen kann[36].
Wissenschaftler arbeiten an der Phänomenologie – wie der Akkumulation abnormaler Proteine in der Zelle oder der Unfähigkeit der Zelle, diese erkrankten Proteine unabhängig voneinander zu eliminieren[37]. Oder der Entzündungszustand der Gliazellen, die zur Ernährung von Neuronen beitragen[38]. Manchmal liegt ein Defekt im intraneuronalen Transportmechanismus von Signalen vor[39] oder es liegt ein Überschuss an Glutamat vor[40].
Vielleicht entdecken wir Defizite bei Nerven[41], Synapsenwachstumsfaktoren oder sogar bei Mitochondrien, den DNA-Zellen, die die genetische Botschaft tragen, die bestimmt, ob wir Tiere oder Pflanzen, Reptilien oder Säugetiere, Männer oder Frauen sind[42]. All dies führt Wissenschaftler zur Verzweiflung: Wir versuchen immer noch zu verstehen, was passiert und wie, aber wir haben immer noch keine Ahnung, warum, doch es muss etwas getan werden, um diese Krankheit zu heilen oder zu stoppen, und deshalb suchen wir nach einer Substanz, die das Fortschreiten der Degeneration verlangsamt.
Die Experimentierphasen

Es kann über 10 Jahre sorgfältiger Planung und Forschung und sogar mehr als eine Milliarde Dollar dauern, bis ein Medikament von der Entdeckung des Moleküls zu seiner Vermarktung gelangt[43]
Wenn ein Pharmaunternehmen glaubt, ein bestimmtes Medikament entdeckt zu haben, beginnt ein experimenteller Prozess, der zu Recht langwierig und notwendig ist, um die Sicherheit und Wirksamkeit der neuen Behandlung festzustellen[44]. Im Labor entwickelt sich zunächst eine sogenannte „präklinische“ Phase, in der der Grad der Toxizität des Moleküls beobachtet wird und der effizienteste Weg für die Verabreichung, Absorption und anschließende Elimination durch den menschlichen Körper bewertet wird. Hierbei handelt es sich um Reagenzglasstudien, bei denen das Molekül mit Zellkulturen oder Mikroorganismen interagieren kann. Wenn die Ergebnisse eine gute Wirksamkeit zeigen, fahren wir mit Experimenten an Tieren wie z. B. Meerschweinchen fort. Wenn diese Phase die Wirksamkeit bestätigt und Verträglichkeit zeigt, beginnt das eigentliche Experimentieren[45].
Phase 1 – Die Verabreichung wird an einer begrenzten Anzahl gesunder Freiwilliger begonnen, deren Hauptziel darin besteht, das mögliche Auftreten von Nebenwirkungen zu überprüfen. Es wird beobachtet, wie das Medikament im menschlichen Körper wirkt und wie der Körper damit umgeht[46]. In Fällen, in denen schwerwiegende Reaktionen beobachtet werden oder die Wirksamkeit mit der Verwendung übermäßig hoher Dosen zusammenhängt, wird das neue Arzneimittel abgesetzt. Das Rennen endet dort.
Phase 2 – Diese Phase untersucht das tatsächliche therapeutische Potenzial des Arzneimittels. Dieses Mal wird das Medikament freiwilligen Probanden verabreicht, die an der Krankheit leiden, für die das Molekül entwickelt wurde. Diese Phase dauert einige Jahre, in denen die positiven und negativen Auswirkungen des therapeutischen Einsatzes des Wirkstoffs analysiert werden – und seine Ungiftigkeit in Bezug auf die Erkrankung des Patienten[47]. Selbst in diesem Stadium besteht eine große Menge von Medikamenten den Test nicht und wird aufgegeben.
Phase 3 – Es gibt eine mögliche neue Therapie. Das Medikament wird zusammen mit anderen bereits für die gleichen Krankheiten entwickelten Medikamenten verwendet, um die Beziehung zwischen Risiko und Nutzen statistisch zu untersuchen. Die Zahl der betroffenen Patienten steigt, die mehrere Tausend Menschen betragen kann. Während dieser Phase, die bis zu fünf Jahre dauern kann, werden das mögliche Auftreten, die Häufigkeit und die Schwere unerwünschter Nebenwirkungen überprüft. Nur wenn das Medikament Wirksamkeit und sehr hohe Verträglichkeit aufweist, genehmigen Behörden (wie die FDA in den USA oder die EMA in der Europäischen Union) seinen Vertrieb und seine Vermarktung[48]. Aber die Prüfungen sind noch nicht überstanden.
Phase 4 – Diese Phase wird als „Überwachung nach dem Inverkehrbringen“ bezeichnet, da sie nach dem Inverkehrbringen durchgeführt wird. Es kann einige Jahre dauern und ist nützlich, um das Auftreten seltener Nebenwirkungen, die in den vorherigen Phasen der Studie nicht aufgetreten waren, genauer zu überprüfen[49]. Es kommt daher mit einer gewissen Häufigkeit vor, dass die Kontrollbehörden in Phase 4 angesichts schwerwiegender Ereignisse beschließen, das Arzneimittel vom Markt zu nehmen und seine Verabreichung zu verbieten.
MediciNova und der MN-166 (Ibudilast)

Die Ibudilast-Formel[50]
Die große Hoffnung, über die wir sprechen, heißt Ibudilast (Entwicklungscode MN-166) und ist ein Medikament, das von der japanischen Firma MediciNova zur Behandlung von Amyotropher Lateralsklerose (ALS) und progressiver Multipler Sklerose vorgeschlagen wurde. Es ist ein kleines Molekül, das die Wirkung bestimmter Enzyme, die als Phosphodiesterase (PDE) bezeichnet werden, hemmt und einen Makrophagenmigrationshemmfaktor (MIF) darstellt[51]: In einfachen Worten verhindert Ibudilast die Übertragung der verantwortlichen degenerativen Faktoren von einer erkrankten Zelle auf eine gesunde Zelle, die später für den Tod von Patienten verantwortlich sind. Die chemischen Elemente binden nach bestimmten Regeln aneinander, bei denen Phosphor verwendet wird, um von einer Zelle zur anderen zu gelangen. Wenn verhindert wird, dass Phosphor wirkt (dies, ist die Hoffnung der Wissenschaftler), breitet sich die Krankheit nicht mehr aus[52].
Das sind Dinge, die wir seit einiger Zeit kennen. Die Entdeckung des Produkts als Phosphodiesterase-Inhibitor geht auf das Jahr 1972 zurück und ist das Werk zweier amerikanischer Ärzte, Petko Uzunov und Benjamin Weiss[53]. 1989 wurde das Ibudilast-Patent von Kyorin Pharmaceutical Company Ltd. Tokio gekauft[54] und erhielt bereits die Lizenz zur Behandlung von Asthma[55]. Da es unter den Nebenwirkungen des Arzneimittels eine Eigenschaft der Entspannung der Blutgefäße und der Bronchialdilatation gibt, wurde das Arzneimittel nach Asthma gegen Schwindel nach einem Schlaganfall verwendet[56]. Die Idee, die Verwendung von Ibudilast bei Multipler Sklerose zu analysieren, kam im Oktober 2004 von japanischen Ärzten eines kleinen Labors namens MediciNova Inc., an das Kyorin eine exklusive Lizenz für die Entwicklung und Vermarktung des Moleküls weltweit verkaufte (ausgenommen Japan, China, Südkorea und Taiwan)[57].
MediciNova, ein Team japanischer Wissenschaftler aus La Jolla, Kalifornien und Tokio[58], wurde im September 2000 als Ableger des Pharmakonzerns Tanabe Seiyaku Company Ltd. Osaka (jetzt Mitsubishi Tanabe Pharma Corporation[59]) gegründet und ist jetzt an beiden amerikanischen Standorten und den japanischen Börsen gelistet. Der Projektträger ist Dr. Yuichi Iwaki[60], der sich auf die Analyse der Möglichkeiten von Arzneimitteln spezialisiert hat, die seiner Meinung nach, die Möglichkeit einer Entwicklung haben würden, die bisher von den Pharmagiganten unterschätzt wurde. In Folge dessen kooperiert er mit kleinen, sehr spezialisierten Teams zusammen, die in Japan in diesem Jahrhundert florieren, um Marktnischen im gigantischen Ozean des US-Marktes zu finden[61].
Im Fachjargon ist MediciNova (MN) auf die Neuprofilierung von Arzneimitteln oder die Übertragung bereits vorhandener Arzneimittel auf einen Therapieplan neuer Studien spezialisiert[62]. MN arbeitet an mehreren Projekten: MN-001 (Tipelukast) gegen alkoholfreie Steatohepatitis und Lungenfibrose[63]; MN-221 (Bedoradrin)[64], MN-029 (Denibulin)[65], insbesondere MN-166 (Ibudilast) gegen neurologische Störungen wie progressive Multiple Sklerose (MS), Amyotrophe Lateralsklerose (ALS), degenerative zervikale Myelopathie (DCM), Drogenabhängigkeit (einschließlich Alkoholismus) und kürzlich seine Verwendung bei der Behandlung von Covid-19-Symptomen wird untersucht[66].
Die Intuition scheint sofort richtig zu sein. Bereits Ende 1990 haben Tierversuche gezeigt, dass Ibudilast der Anreicherung von Kalzium im Zentralnervensystem und in der Bauchaorta entgegenwirken kann – es verhindert Phosphodiesterase, sodass gesunde Zellen nicht krank werden[67]. Im Jahr 1991 zeigt es seine Wirksamkeit bei Kopfschmerzen, weil es auch ein Vaso-Relaxer ist[68]. 1993 wurde seine vorteilhafte Wirkung bei ischämischen Schlaganfällen bestätigt[69]. Zwei Jahre später wird die Wirksamkeit von Ibudilast bei der Behandlung von Durchblutungsstörungen der unteren Extremitäten von Diabetikern beobachtet[70].
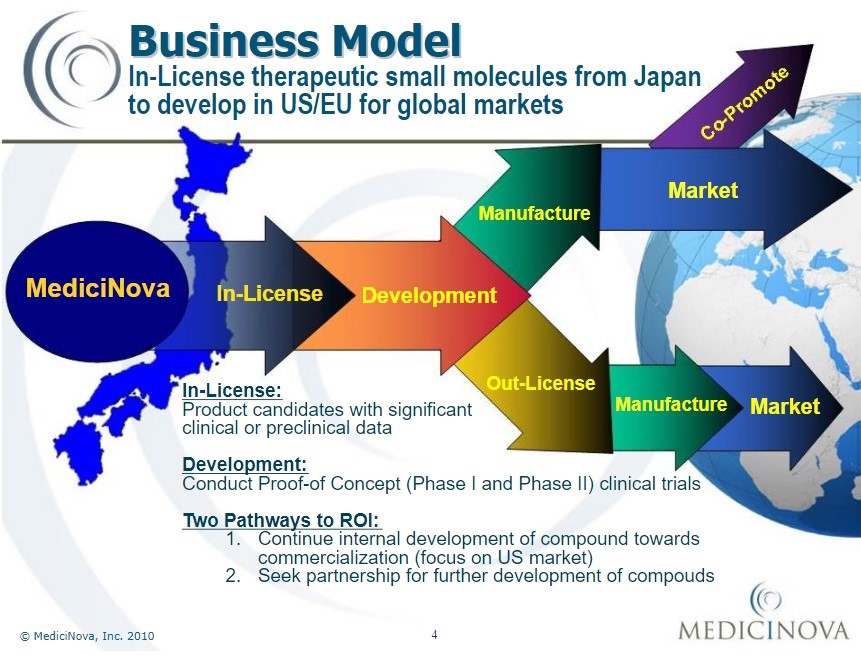
Geschäftsmodell seit 2010 von MediciNova Inc.[71]
Der eigentliche Durchbruch gelang 1996, als eine Studie ergab, dass das Medikament der Neurotoxizität von Glutamat in kultivierten Neuronen des Hippocampus einer Ratte entgegenwirken konnte[72]. Glutamat, das als einer der wichtigsten Neurotransmitter in unserem Nervensystem gilt, steht seit Langem im Mittelpunkt von neurologischen Erkrankungen wie ALS. In einigen Fällen reagiert der Körper über auf dieses Enzym, was zu Neurotoxizität und anschließendem neuronalen Tod führt. Ibudilast verhindert Phosphodiesterase und wirkt daher dieser Dynamik entgegen[73].
Im Jahr 1997 bestätigte die Forschung seine entzündungshemmende Wirkung, da es die Infektion von Gliazellen abschwächt[74]. Die Ergebnisse legen nahe, dass Forscher ihren therapeutischen Nutzen bei anderen Atemwegserkrankungen und schließlich bei neurologischen Erkrankungen wie ALS oder den Auswirkungen der Drogenabhängigkeit testen sollten[75]. Kurz danach bekommt man weitere Bestätigungen: Im Jahr 1999 wirkt das Medikament bei einer Rattenkrankheit der experimentellen Autoimmunenzephalomyelitis, sodass Ibudilast ein vollständiger Kandidat für die klinische Behandlung von ALS-Patienten wird[76].
Die präklinische Phase findet im Jahr 2004 statt und die Ergebnisse sind mehr als ermutigend[77]. Kyorin möchte es jedoch so schnell wie möglich kommerzialisieren können und konzentriert sich 2007 (mit Erfolg) auf die Behandlung neuropathischer Schmerzen: Die Pharmakotherapie basiert im Allgemeinen auf der Verwendung von Opioidanalgetika, die jedoch nur eine bescheidene Wirksamkeit aufweisen und auf der anderen Seite zahlreiche Nebenwirkungen zeigen, wie Syndrome von Sucht und Abstinenz. Ibudilast, das in Kombination mit Opioiden angewendet wird, scheint eine doppelte Wirkung zu haben: die Verstärkung der analgetischen Wirkung und die signifikante Hemmung des Suchtsyndroms[78].
Zu diesem Zeitpunkt betritt MediciNova das Feld, wenn auch mit nicht allzu zufriedenstellenden Ergebnissen. Eine Studie, die 2010 an 297 Patienten mit Multipler Sklerose nach 12 Monaten durchgeführt wurde, endet mit einer Niederlage: „Ibudilast zeigte keine vorteilhaften Auswirkungen auf die Neuheitsrate aktiver Läsionen und Rückfälle. Erste Hinweise deuten jedoch darauf hin, dass Ibudilast neuroprotektiv zu wirken scheint (…) und möglicherweise einen positiven klinischen Effekt auf das Fortschreiten der Behinderung hat“[79].
MediciNova gibt das Spiel nicht auf und experimentiert mit MN-166 (der Name von Ibudilast im Katalog von Yuichi Iwakis Labor), gepaart mit anderen Behandlungen: Sie wollen ALS nicht heilen, sondern nur das Fortschreiten der Symptome verlangsamen. Auf dieser Grundlage genehmigte die FDA (Food and Drug Administration) 2012 den Beginn der Phase 2 der klinischen Studie (IBU-ALS-1201). Ihr Hauptziel ist es, die Sicherheit und Verträglichkeit von MN-166 bei der Behandlung von Menschen mit Amyotropher Lateralsklerose in der EU zu bewerten[80].
Im selben Jahr wurde zwischen MediciNova und der University of Colorado eine gemeinsame Entwicklungsvereinbarung zur Behandlung von posttraumatischen Hirnverletzungen unterzeichnet[81]. 2013 wird MediciNova für eine Phase 2b (NCT01982942) aktiviert, mit der die Sicherheit, Verträglichkeit und Wirksamkeit von Ibudilast auch bei Patienten mit progressiver Multipler Sklerose überprüft werden soll[82]. Die Studie wird in Zusammenarbeit mit den National Institutes of Health (NIH)[83], dem National Institute of Neurological Disorders and Stroke (NINDS)[84] und der National Multiple Sclerosis Society durchgeführt[85]. Pharmaceutical America beginnt an das Projekt zu glauben.
Dann kommen die positiven Ergebnisse mit der typischen Langsamkeit eines Verfahrens, das mit solch einer schrecklichen Krankheit verbunden ist. Im Jahr 2015 fanden Untersuchungen heraus, dass alkoholabhängige Mäuse ihre Sucht um 50 % reduzierten, wenn sie mit Ibudilast behandelt wurden[86]. Ein Team eines anderen Unternehmens stellt nach einer sorgfältigen vorklinischen Analyse fest, dass, obwohl keine Abnahme der Entzündung bei Multipler Sklerose festgestellt wurde, klar ist, dass Ibudilast einen positiven Effekt auf die Erhaltung des Gehirnvolumens hat und daher das Fortschreiten der Behinderung verlangsamt[87]. Im Oktober 2016 gewährt die FDA MediciNova weitere sieben Jahre Exklusivität, um Studien und Experimente zu diesem Projekt durchführen zu können[88].

Ein Mitarbeiter der MediciNova Laboratories bei der Arbeit
Im März 2018 beschließt Iwaki, die Experimente zur Behandlung von Drogenabhängigkeit abzubrechen – die Ergebnisse sind zu schlecht[89]. Die FDA bedauert die Entscheidung und behauptet, dass die Ergebnisse besagen, dass MN-166 „das Verlangen (und damit die Sucht) reduziert und die kognitiven Funktionen verbessert„[90] und bietet MediciNova an, mit Phase 2 fortzufahren. Im August 2018 hat MediciNova in Zusammenarbeit mit der University of Cambridge und dem Cambridge University Hospitals NHS Foundation Trust die Einleitung einer Phase-2-Studie zu MN-166 bei zervikaler degenerativer Myelopathie angekündigt[91]. Die Studie konzentriert sich auf die Fähigkeit des Moleküls, das Nervenwachstum bei traumatischen Rückenmarksverletzungen zu fördern. Die Studie endet mit einem Triumph am 19. März 2020[92]. Die Ergebnisse der Phase-2-Studie sind sehr ermutigend[93]: Die Behandlung mit MN-166 verlangsamt das Fortschreiten der Krankheit und übt darüber hinaus eine schützende Wirkung aus, wodurch das Risiko neuer entzündlicher Läsionen erheblich verringert wird[94].
Diese Ergebnisse überzeugen die FDA davon, dass das Medikament wirklich eine Zukunft hat und daher kommt die Zulassung für Phase 3[95], trotz der Tatsache, dass das kleine Labor nicht über die gesetzlich vorgeschriebenen Infrastrukturen verfügt, die es erforderlich machen, die Ergebnisse jeder Verabreichung, jeder Therapie und jedes Patienten tatsächlich zu überprüfen – was in der Pharmazie als „Endpoint“ bezeichnet wird und die Angemessenheit einer Behandlung feststellt[96]. Die USA halten Sklerose jedoch für so schwerwiegend, dass sie 2015 beschlossen haben, das Netz bei besonders vielversprechenden Produkten für sogenannte Orphan-Krankheiten zu erweitern, da diese immer noch unheilbar sind[97]. Um Phase 3 zu erhalten, muss MediciNova nachweisen, dass eine erhebliche Anzahl von Patienten bereit ist, Risiken einzugehen und bei Sklerose ist es nicht schwierig, sie zu finden[98]. Der Beginn der klinischen Phase-3-Studie beginnt also im Sommer 2020[99].
Im August bestätigte die American Psychological Association, die eine Zusatzprüfung mit MN-166 durchführte, dass Ibudilast das tägliche Verlangen von Alkoholikern erheblich reduziert[100]. Einige Monate später, im Dezember, gibt die FDA die Verwendung von MN-166 in Kombination mit einem anderen Medikament, Interferon Beta zur Behandlung von progressiver Multipler Sklerose frei[101]. Im Januar 2021 erhielt MediciNova von den japanischen Behörden die Lizenz zur Verwendung von MN-166 in Kombination mit Riluzol (ein Medikament, das die negative Wirkung von Glutamat verhindert[102]) zur Behandlung von Amyotropher Lateralsklerose (ALS)[103].
Vor einigen Tagen unterzeichnete MediciNova einen Vertrag mit BARDA (Biomedical Advanced Research and Development Authority[104]), um MN-166 als Gegenmaßnahme gegen Chlorgas-induzierte Lungenschäden wie akutes Atemnotsyndrom (ARDS) und akuten Lungenschaden (ALI) zu testen[105]. Es scheint, als wären wir nur noch einen Schritt davon entfernt, die Lizenz zu erhalten, einen Schritt davon entfernt, den Tausenden neuer Sklerosepatienten sagen zu können, dass es echte Hoffnung gibt. Aber der Weg dorthin ist immer noch lang, bergauf und voller Schwierigkeiten.
Dieser endlose Hürdenlauf
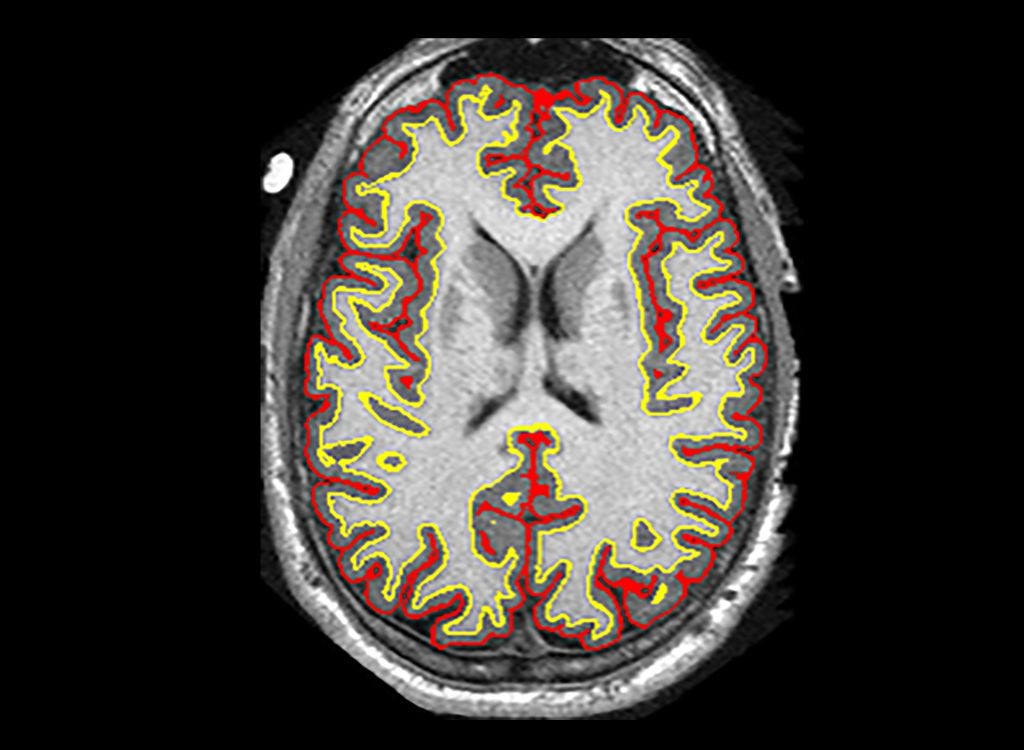
Phase II: Die Forscher fanden heraus, dass eine Gruppe von Hirnschäden bei Patienten um durchschnittlich 2,5 Milliliter mehr reduziert war als bei anderen Behandlungen – ein Unterschied von etwa 48%[106]
Forschung und Entwicklung eines Arzneimittels verursachen enorme Kosten. Laut einer im März 2020[107] im Jama Network veröffentlichten Studie kostet die Entwicklung eines neuen Arzneimittels durchschnittlich 985 Millionen Dollar: von mindestens 314 Millionen Dollar bis maximal 2,8 Milliarden Dollar[108]. Es kann bis zu 15 Jahre dauern, bis ein Pharmaunternehmen sein Produkt zum Verkauf anbietet. Falls Sie auf halbem Weg aufhören, weil Ihr Geld weg ist, haben Sie nichts mehr in der Hand.
Der Wettbewerb stellt ein entscheidendes Risiko dar. Oft arbeiten mehrere Firmen gleichzeitig an einem Medikament – und nur eine gewinnt. Es besteht daher das Risiko, jahrelang Millionen von Dollar in eine Behandlung investiert zu haben und auf der letzten Meile von einem wirksameren Medikament überholt zu werden, das von einem Konkurrenten entwickelt wird, besser vertragen wird und sogar billiger ist. Noch schwieriger ist das Rennen für kleine Unternehmen, die gerade erst anfangen und noch kein erfolgreiches Medikament auf dem Markt haben: MediciNova verzeichnete allein im Jahr 2020 einen Nettoverlust von 13,9 Millionen Dollar. Wenn Sie die Kosten seit Beginn der MN-166-Studie berücksichtigen, liegen wir bereits bei 382,9 Millionen US-Dollar. Bis MN-166 oder eines der anderen neuen Medikamente in Produktion geht, wird es noch schlimmer[109].
Die Wahrheit ist, dass MediciNova in Schulden ertrinkt. Es hat die Anzahl der Mitarbeiter von 25 (2009) auf 8 (2019) reduziert[110] und die einzige Hoffnung, worauf das Team von Dr. Iwaki alles setzt, besteht darin, strategische Allianzen mit großen Pharmaunternehmen einzugehen, die an die Zukunft von MN-166 und MN-001 glauben – eine falsche Einschätzung[111]. Bei unseren Recherchen haben wir drei multinationale Pharmaindustrien kontaktiert. Die Antwort war immer dieselbe: Warum sollten wir uns einig werden und dafür 100 zahlen, wenn wir vermutlich nach der Insolvenz von MediciNova nur 10 zahlen würden? Das Ergebnis: Das kapitalhungrige Unternehmen beschließt, seine Strategie auf die Entwicklung eines Impfstoffs gegen Covid-19 auszurichten, und kündigt im Juli 2020 den Beginn der Entwicklung eines neuen Arzneimittels zusammen mit BioComo Inc. Tsu[112] und dem institutionellen Partner von Biocomo the Mie Universität von Tsu an[113].
Aber dieses Medikament wirkt nicht. Im März 2021 stornierte MediciNova das Projekt[114] und ersetzte es durch eine Partnerschaft, die mit BARDA (Biomedical Advanced Research and Development Authority) begann, die sich verpflichtet hat, die Entwicklung von MN-166 finanziell und technologisch zu unterstützen[115]. Die Ankündigung erhöht den Wert der MediciNova-Aktien, die sich anschließend verdoppeln[116]. Das Geld, das in der Tasche gesammelt wird, ist wie Manna vom Himmel. Inzwischen hat MediciNova den MN-221 gegen Asthma und die Version von MN-166 in Kombination mit Riluzol zur Behandlung von Amyotropher Lateralsklerose (ALS) auf den Markt gebracht, da erwartet wird, dass sie bald eine dauerhafte Lizenz erhalten[117].
Es ist ein Wettlauf gegen die Zeit, da die Erteilung des Patents im November 2035 ausläuft[118]. Da Ibudilast ein Patent von 1989 ist, wird es ab 2039 auf jeden Fall ein freies Patent sein wie das von Aspirin und jeder kann es verkaufen, egal wie viel Geld MediciNova investiert hat, um es zu entwickeln. In den USA wird MN-166 inzwischen in vielen Universitätskliniken an Patienten verabreicht, die sich anmelden, um die Verantwortung dafür zu übernehmen. Multiple Sklerose ist eine Krankheit, die den betroffenen Menschen zerstört und zwar auf langsame, grausame und unumstößliche Weise. Falls Sie glauben, dass Arzneimittel das „Land der Spielereien“ seien, in dem jeder exorbitante Zahlen verdienen kann, ohne Kosten zu haben, welche die Listenpreise rechtfertigen können, soll man sich an diese Geschichte erinnern. Und bete, dass Ibudilast wirklich funktioniert, wie es scheint: Denn mit jedem verlorenen Tag werden auch Menschenleben verloren gehen.
[1] https://www.who.int/news-room/fact-sheets/detail/dementia#:~:text=Worldwide%2C%20around%2050%20million%20people,60%E2%80%9370%25%20of%20cases.
[2] https://comitatoparkinson.it/i-numeri-del-parkinson-in-italia/#:~:text=%E2%80%9CMEDICINA%3A%20Parkinson%2C%20400%20mila,%C3%A8%20legata%20all’et%C3%A0%20avanzata.
[3] https://journals.sagepub.com/doi/full/10.1177/1352458520970841#:~:text=A%20total%20of%202.8%20million,gaps%20in%20prevalence%20estimates%20persist.
[4] https://www.karger.com/Article/Fulltext/493386
[5] https://www.sciencedirect.com/science/article/pii/B9780123750006000847
[6] https://www.sciencedirect.com/science/article/pii/B9780750614474500074
[7] https://www.sciencedirect.com/science/article/pii/B9780123750006000847
[8] https://www.sciencedirect.com/science/article/pii/B9780750614474500074
[9] https://microspedia.blogspot.com/2020/11/real-electron-microscope-nerve-cell.html
[10] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[11] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[12] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[13] Gilles Clément, Angie Buckey, William Paloski, “Artificial Gravity – History of artificial gravity”, Springer Science & Business, Berlin 2007, pages 62-65; https://www.ncbi.nlm.nih.gov/books/NBK21535/
[14] https://www.newworldencyclopedia.org/entry/Soma_(biology)
[15] https://www.newworldencyclopedia.org/entry/Dendrite
[16] https://itechmedicaldivision.com/elettrostimolazione-e-contrazione-volontaria/
[17] https://www.newworldencyclopedia.org/entry/Axon
[18] https://www.syfy.com/syfywire/go-beyond-the-infinite-with-2001-a-space-odysseys-discovery
[19] https://www.newworldencyclopedia.org/entry/Axon
[20] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[21] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[22] https://web.archive.org/web/20111107033302/http://www.storiain.net/arret/num50/artic6.htm ; www.monci.it/homogubernator/Elettromagnetismo/2E_Pile_Zamboni.htm
[23] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[24] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1860500/
[25] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1860500/
[26] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4191298/
[27] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4191298/
[28] https://alienanthology.fandom.com/wiki/The_Beast_Within:_The_Making_of_Alien
[29] https://www.rchsd.org/health-articles/lou-gehrigs-disease-als/
[30] https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-Sheets/Motor-Neuron-Diseases-Fact-Sheet
[31] https://www.policlinicocampusbiomedico.it/malattie/sclerosi-laterale-primaria#:~:text=La%20sclerosi%20laterale%20primaria%20%C3%A8,andamento%20dei%20sintomi%20%C3%A8%20progressivo.
[32] https://pubmed.ncbi.nlm.nih.gov/26515620/
[33] https://studiodiagnosticopantheon.it/latrofia-muscolare-progressiva-la-malattia-di-stephen-hawking/
[34] https://www.ninds.nih.gov/disorders/patient-caregiver-education/fact-sheets/amyotrophic-lateral-sclerosis-als-fact-sheet
[35] https://medlineplus.gov/ency/article/003188.htm
[36] https://www.aisla.it/vivere-con-la-sla/ipotesi-sulle-cause-della-sla/
[37] https://link.springer.com/article/10.1007/s00401-009-0545-9
[38] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4241182/
[39] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5536153/
[40] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2842587/
[41] https://pubmed.ncbi.nlm.nih.gov/21706151/
[42] https://pubmed.ncbi.nlm.nih.gov/17204932/
[43] https://toolbox.eupati.eu/resources/realizzare-un-farmaco-fase-6-fase-i-prova-del-meccanismo/?lang=it
[44] https://www.aifa.gov.it/sperimentazione-clinica-dei-farmaci
[45] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[46] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[47] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[48] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[49] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[50] http://www.arisla.org/?p=8686
[51] https://www.openaccessjournals.com/articles/ibudilast-for-the-treatment-of-drug-addiction-and-other-neurological-conditions.pdf
[52] https://www.openaccessjournals.com/articles/ibudilast-for-the-treatment-of-drug-addiction-and-other-neurological-conditions.pdf
[53] https://chemport.cas.org/cgi-bin/sdcgi?APP=ftslink&action=reflink&origin=npg&version=1.0&coi=1%3ACAS%3A528%3ADyaE38XlsVyqtLw%3D&md5=93f10eb1f2cc78a01c54153040f0fdf4 ; https://www.sciencedirect.com/science/article/abs/pii/0005274472900605?via%3Dihub
[54] https://www.kyorin-pharm.co.jp/en/
[55] https://pubmed.ncbi.nlm.nih.gov/2556092/
[56] https://pubchem.ncbi.nlm.nih.gov/compound/3671
[57] https://materials.proxyvote.com/default.aspx?docHostID=322881
[59] https://www.mt-pharma.co.jp/e/
[60] https://www.crunchbase.com/person/yuichi-iwaki
[61] https://plus.credit-suisse.com/rpc4/ravDocView?docid=V6A35B2AK-e
[62] https://www.nature.com/articles/nrd.2018.168 ; https://plus.credit-suisse.com/rpc4/ravDocView?docid=V6A35B2AK-e
[63] https://medicinova.com/clinical-development/core/mn-001-nash/
[64] https://medicinova.com/clinical-development/core/mn-221/
[65] https://medicinova.com/clinical-development/non-core/mn-029/medicinova-approach/ ; https://www.sec.gov/Archives/edgar/data/1226616/000156459019002835/mnov-10k_20181231.htm
[66] https://medicinova.com/clinical-development/core/mn-166/ ; https://www.scienceboard.net/index.aspx?sec=sup&sub=Drug&pag=dis&ItemID=1749
[67] https://pubmed.ncbi.nlm.nih.gov/2257963/
[68] https://headachejournal.onlinelibrary.wiley.com/doi/abs/10.1111/j.1526-4610.1991.hed3107483_1.x?sid=nlm%3Apubmed
[69] https://www.tandfonline.com/doi/abs/10.1080/01616412.1993.11740130
[70] https://journals.sagepub.com/doi/10.1177/000331979504600808
[71] Slide Presentation (sec.gov)
[72] https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1440-1681.1996.tb02772.x
[73] https://lamenteemeravigliosa.it/il-glutammato-neurotrasmettitore-multifunzione/
[74] https://pubmed.ncbi.nlm.nih.gov/9396033/
[75] http://rsds.org/wp-content/uploads/2015/02/Rolan_Ibudilast_Review.pdf
[76] https://www.jni-journal.com/article/S0165-5728(98)00251-3/fulltext
[77] https://journals.sagepub.com/doi/10.1191/1352458504ms1070oa ; https://www.sciencedirect.com/science/article/abs/pii/S0028390803003721?via%3Dihub
[78] https://www.tandfonline.com/doi/abs/10.1517/13543784.16.7.935?journalCode=ieid20 ; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2662518/
[79] https://n.neurology.org/content/74/13/1033
[80] https://clinicaltrials.gov/ct2/show/record/NCT02238626
[81] https://connections.cu.edu/stories/cu-boulder-medicinova-collaborate-brain-injury-therapy
[82] https://clinicaltrials.gov/ct2/show/study/NCT01982942
[83] https://www.ninds.nih.gov/
[84] https://www.ninds.nih.gov/
[85] https://www.nationalmssociety.org/
[86] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4017009/
[87] https://www.tandfonline.com/doi/abs/10.1080/13543784.2016.1221924?journalCode=ieid20
[88] https://alsnewstoday.com/news-posts/2016/10/18/ibudilast-mn-166-named-orphan-drug-for-amyotrophic-lateral-sclerosis-by-fda/
[89] https://www.globenewswire.com/news-release/2018/03/29/1455342/0/en/MediciNova-Announces-Results-of-Phase-2-Clinical-Trial-of-MN-166-ibudilast-in-Methamphetamine-Dependence.html
[90] https://www.researchgate.net/publication/297599603_Ibudilast_attenuates_subjective_effects_of_methamphetamine_in_a_placebo-controlled_inpatient_study
[91] https://www.globenewswire.com/news-release/2018/08/06/1547763/0/en/MediciNova-Announces-Initiation-of-NIHR-Grant-Funded-Phase-2-3-Trial-of-MN-166-ibudilast-for-the-Treatment-of-Degenerative-Cervical-Myelopathy-in-Collaboration-with-the-University-.html
[92] https://www.clinicaltrialsregister.eu/ctr-search/trial/2017-004856-41/GB#A
[93] https://www.nejm.org/doi/full/10.1056/NEJMoa1803583?query=featured_home
[94] https://www.globenewswire.com/news-release/2008/09/18/385032/150688/en/Data-From-MediciNova-s-Two-Year-Phase-II-Clinical-Trial-of-MN-166-in-Multiple-Sclerosis-Presented-At-the-World-Congress-for-Treatment-and-Research-in-MS-WCTRIMS.html ; https://www.nejm.org/doi/full/10.1056/NEJMoa1803583?query=featured_home
[95] http://www.globenewswire.com/news-release/2018/09/25/1576125/0/en/MediciNova-Announces-Positive-FDA-Feedback-Regarding-Phase-3-Plan-for-MN-166-ibudilast-in-ALS.html
[96] https://www.sec.gov/Archives/edgar/data/1226616/000156459019002835/mnov-10k_20181231.htm
[97] https://www.fdanews.com/articles/172717-fda-indicates-flexibility-in-drug-development-for-rare-diseases?utm_source=Real%20Magnet&utm_medium=Email&utm_campaign=80249611
[98] https://www.regulations.gov/document/FDA-2015-D-2818-0002 “Rare Diseases: Common Issues in Drug Development Guidance for Industry” U.S. Department of Health and Human Services – Food and Drug Administration – Center for Drug Evaluation and Research (CDER) – Center for Biologics Evaluation and Research (CBER) – August 2015
[99] http://www.arisla.org/?p=8686
[100] https://www.biospace.com/article/releases/medicinova-announces-the-presentation-of-positive-results-from-phase-2-trial-of-mn-166-ibudilast-in-alcohol-use-disorder-at-the-american-psychological-association-2020-annual-convention/
[101] https://www.globenewswire.com/news-release/2020/12/29/2151193/0/en/MediciNova-Receives-Notice-of-Allowance-for-New-Patent-Covering-MN-166-ibudilast-for-the-Treatment-of-Progressive-MS.html
[102] https://medisoc.it/scheda-riluzolo/
[103] https://seekingalpha.com/pr/18155450-medicinova-receives-notice-of-allowance-for-new-patent-covering-combination-of-mnminus-166
[104] https://www.phe.gov/about/barda/Pages/default.aspx
[105] https://www.globenewswire.com/news-release/2021/03/09/2189908/0/en/MediciNova-Announces-Partnership-with-BARDA-to-Develop-MN-166-ibudilast-as-a-Medical-Countermeasure-Against-Chlorine-Gas-induced-Lung-Injury.html
[106] https://news.ohsu.edu/2018/09/05/study-suggests-potential-of-new-therapy-for-progressive-multiple-sclerosis
[107] Autore Olivier J. Wouters, PhD, Department of Health Policy, London School of Economics and Political Science, Houghton Street, London WC2A 2AE, United Kingdom.
[108] https://jamanetwork.com/journals/jama/article-abstract/2762311
[109] https://sec.report/Document/0001564590-21-006771/#ITEM_7_MANAGEMENTS_DISCUSSION_ANALYSIS_1 pag. 55
[110] https://www.macrotrends.net/stocks/charts/MNOV/medicinova/number-of-employees
[111] https://sec.report/Document/0001564590-21-006771/#ITEM_7_MANAGEMENTS_DISCUSSION_ANALYSIS_1 pag. 55
[112] http://biocomo.jp/english.html
[113] https://www.globenewswire.com/news-release/2020/07/27/2067757/0/en/MediciNova-Announces-SARS-CoV-2-Vaccine-Joint-Development-with-BioComo-and-Mie-University-Japan.html
[114] https://www.theglobeandmail.com/investing/markets/stocks/MNOV-Q/pressreleases/1242556/
[115] https://drive.hhs.gov/ReDIRECT.html
[116] https://www.nasdaq.com/articles/medicinova-partners-with-barda-to-develop-chlorine-gas-induced-lung-injury-treatment-stock
[117] https://seekingalpha.com/pr/18155450-medicinova-receives-notice-of-allowance-for-new-patent-covering-combination-of-mnminus-166
[118] https://alsnewstoday.com/news-posts/2019/01/23/medicinova-closer-to-us-patent-ibudilast-rilutek-combo-for-als-neurodegenerative-diseases/
Schreibe einen Kommentar